
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJmol-1
一种工业合成氨的简易流程图如图:
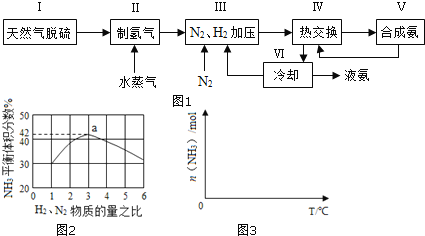
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJmol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJmol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___(填序号),简述本流程中提高合成氨原料总转化率的方法:___。
【答案】2NH4HS+O2=2NH3·H2O+2S↓ a 90% 14.5%  Ⅳ 分离液氨,未反应的氮气和氢气循环使用
Ⅳ 分离液氨,未反应的氮气和氢气循环使用
【解析】
![]() 与
与![]() 发生氧化还原反应;
发生氧化还原反应;
(2)根据影响反应速率的因素、影响平衡移动的因素分析能提高平衡体系中H2百分含量,又能加快反应速率的方法;利用“三段式”计算CO转化率;
(3)利用“三段式”计算a点N2的平衡体积分数;
(4)随着反应的进行,![]() 的物质的量逐渐增大,当反应平衡后,升高温度,平衡向左移动,
的物质的量逐渐增大,当反应平衡后,升高温度,平衡向左移动,![]() 的物质的量逐渐减小;
的物质的量逐渐减小;
![]() 分析流程合成氨放热,通过Ⅳ热交换器加热反应混合气体;把平衡混合气体中氮气和氢气重新循环使用;
分析流程合成氨放热,通过Ⅳ热交换器加热反应混合气体;把平衡混合气体中氮气和氢气重新循环使用;
![]() 把
把![]() 氧化为S,化学方程式是
氧化为S,化学方程式是![]() ;
;
![]() 、反应
、反应![]() 为吸热反应,升高温度,反应速率加快,平衡向右移动,
为吸热反应,升高温度,反应速率加快,平衡向右移动,![]() 的百分含量增大,故a正确;
的百分含量增大,故a正确;
b、增大水蒸气浓度,![]() 的百分含量减小,故b错误;
的百分含量减小,故b错误;
c、加入催化剂,平衡不移动,![]() 的百分含量不变,故c错误;
的百分含量不变,故c错误;
d、降低压强,反应速率减小,故d错误;
设CO的转化量为x
![]()
转化量![]()
![]() 0
0 ![]()
转化量![]() x x x
x x x
平衡量![]()
![]() x
x ![]()
![]() ,则
,则![]() ,可得CO转化率
,可得CO转化率![]() ;
;
![]() 根据图1可知a点
根据图1可知a点![]() 与
与![]() 的投料比为3,平衡时
的投料比为3,平衡时![]() 体积分数为
体积分数为![]() ,设
,设![]() 物质的量为3amol,
物质的量为3amol,![]() 物质的量为amol,
物质的量为amol,![]() 转化的物质的量为x,则
转化的物质的量为x,则 ![]()
转化量![]() a 3a 0
a 3a 0
转化量![]() x 3x 2x
x 3x 2x
平衡量![]()
![]()
![]() 2x
2x
![]() ,解得
,解得![]() ,则
,则![]() 的平衡体积分数
的平衡体积分数![]() ;
;
![]() 随着反应的进行,
随着反应的进行,![]() 的物质的量逐渐增大,当反应平衡后,升高温度,平衡向左移动,
的物质的量逐渐增大,当反应平衡后,升高温度,平衡向左移动,![]() 的物质的量逐渐减小,可画出图象为:
的物质的量逐渐减小,可画出图象为:
![]() ;
;
![]() 分析流程合成氨放热,通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率。
分析流程合成氨放热,通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的数值,则下列说法中不正确的是
为阿伏伽德罗常数的数值,则下列说法中不正确的是
![]() 常温下,21g聚乙烯
常温下,21g聚乙烯![]() 中含有氢原子的数目为
中含有氢原子的数目为![]()
![]() 在
在![]() 反应中每生成71g氯气转移的电子数为
反应中每生成71g氯气转移的电子数为![]()
![]() 中含
中含![]() 键数目为
键数目为![]()
![]() 过氧化钠与水反应,若转移
过氧化钠与水反应,若转移![]() 个电子,则产生的氧气为32g
个电子,则产生的氧气为32g
![]() 在
在![]() 的碳酸钠溶液中,
的碳酸钠溶液中,![]() 总数为
总数为![]() .
.
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验说法,不正确的是
A.苯酚不慎沾到皮肤上,应立即用酒精洗涤,再用大量水冲洗
B.KCl和MnO2的混合物经溶解、过滤、洗涤、干燥,可分离出MnO2
C.用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D.火柴头的浸泡液中滴加AgNO3溶液、稀HNO3和NaNO2溶液,可检验火柴头是否含有氯元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定混合气中![]() 含量可计算已变质的
含量可计算已变质的![]() 含
含![]() 纯度,实验装置如图
纯度,实验装置如图![]() 为弹性良好的气囊
为弹性良好的气囊![]() ,下列分析错误的是
,下列分析错误的是![]()
![]()
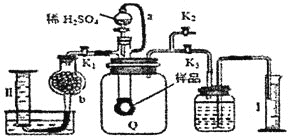
A.干燥管b中装入碱石灰
B.测定气体总体积必须关闭![]() 、
、![]() ,打开
,打开![]()
C.测定总体积后,关闭![]() ,打开
,打开![]() ,可观察到Q气球慢慢缩小,并测出氧气体积
,可观察到Q气球慢慢缩小,并测出氧气体积
D.Q气球中产生的气体主要成份![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
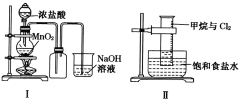
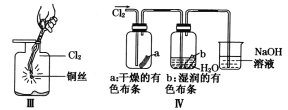
A. I图中:如果MnO2过量,浓盐酸就可全部被消耗
B. II图中:量筒中发生了加成反应
C. III图中:生成蓝色的烟
D. IV图中:湿润的有色布条能褪色将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A. 室温下,pH=1的溶液中:Na+、Fe3+、NO![]() 、SO
、SO![]()
B. 含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO![]()
C. 加入铝粉有气泡产生的溶液中:Na+、NH![]() 、Fe2+、NO
、Fe2+、NO![]()
D. 在AlCl3溶液中:K+、Na+、SiO![]() 、SO
、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
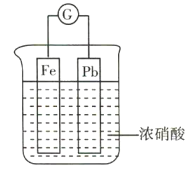
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
烧渣![]() 溶液
溶液![]() 绿矾
绿矾![]() 铁黄
铁黄
已知:FeS2和铁黄均难溶于水
下列说法不正确的是( )
A.步骤①,最好用硫酸来溶解烧渣
B.步骤②,涉及的离子反应为FeS2+14Fe3++8H2O=15Fe2++2SO![]() +16H+
+16H+
C.步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,实验室里用![]() 的盐酸溶液滴定
的盐酸溶液滴定![]() 氨水溶液,若用AG表示溶液的酸度,其表达式为:
氨水溶液,若用AG表示溶液的酸度,其表达式为: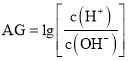 ,滴定曲线如图所示,下列说法正确的是
,滴定曲线如图所示,下列说法正确的是![]()
![]()
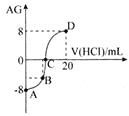
A.D点溶液中离子浓度关系为:![]()
B.C点加入盐酸的体积为10mL
C.若B点加入的盐酸溶液体积为5mL,所得溶液中:![]()
D.滴定过程中从A点到D点溶液中水的电离程度逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com