
| △H1+△H2 |
| 2 |
| 32 |
| 400t×2.5%×96% |
| 172 |
| m |
| 0.75×0.75 |
| 0.25×0.753 |
| 0.75×(0.75+1.5) |
| (0.25+0.25)×0.753 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 已知X是一种盐,H是常见的金属单质,F、I是常见的非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题:
已知X是一种盐,H是常见的金属单质,F、I是常见的非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、73g氯化氢溶于水中,所含氯化氢分子数为2NA |
| B、标准状况下,18g水所含的原子数目为NA |
| C、标准状况下,22.4L氮气所含的原子数目为NA |
| D、常温常压下,2.8gCO和N2混合气体所含原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
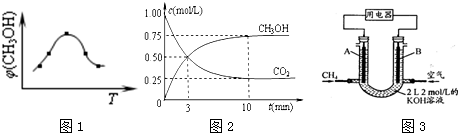
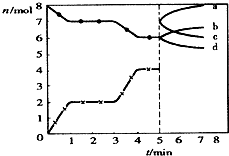 炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=QkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )
炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=QkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )A、0~lmin,v(CO)=1mol/(L?min);1~3min时,v(CO)=v(CO2);该反应的平衡常数表达式为k=
| ||
B、当容器内的压强不变时,该反应一定达到平衡状态,且
| ||
C、3min时温度由T1升高到T2,则Q>O,重新平衡时
| ||
| D、5min时再充入一定量的CO,c、b曲线分别表示n(CO)、n(CO2)的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种气体的质量相等 |
| B、两容器中气体的密度相等 |
| C、两种气体的分子数目相等 |
| D、两种气体的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com