
下列试剂中,能将NaCl、NH4Cl和FeCl3三种溶液区分开的是
A.HNO3溶液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
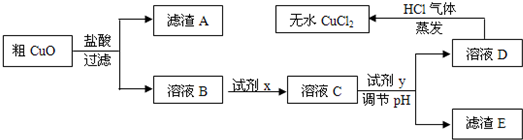
| aNA |
| 80 |
| b |
| 135 |
| 64b |
| 135a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
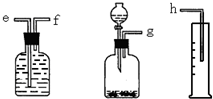 (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)
(1)在密闭容器里,通入x mol SO2和y mol O2,发生化学反应:2SO2(g) + O2 (g) 2SO3 (g) ;当其它条件不变时,改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
①降低温度____________________;?
②当容器容积不变,充入更多的O2____________________ ;?
③当容器容积不变,通入氖气____________________。
(2)来自石油的基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
④可以用来鉴别苯蒸气和乙烯的试剂是____________________(填序号)。
A.水 B.溴的四氯化碳溶液 C.酸性高锰酸钾溶液
⑤苯分子具有平面正六边形结构,所有原子共一个平面,则苯分子中在一条直线上的原子最多有____________________ 个。
⑥在一定条件下,乙烯能与水发生加成反应生成有机物A,写出A与Na反应的化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013届贵州省遵义四中高三第二次月考理科综合化学试卷(带解析) 题型:实验题
(16分)(1)(6分)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
①用接口字母标出各仪器连接的顺序 量筒在实验中的作用是
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是 。(假设在标准状况下测定)
(2)(10分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C具有还原性
C.维生素C将Fe3+还原为Fe2+ D.在上述变化中亚硝酸盐是还原剂
②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
④ Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
⑤配平下列方程式:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:选择题
NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋
白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力。
(1)美蓝是亚硝酸盐中毒的有效解毒剂,下列说法正确的是 。(选填编号)
A.解毒时美蓝表现氧化性 B.中毒时亚硝酸盐发生氧化反应
C.解毒时高铁血红蛋白被还原 D.中毒过程中血红蛋白显氧化性
(2)NaNO2中钠离子核外有 种不同能级的电子,三种元素对应的简单离子半径由大到小的顺序为 。
(3)Na、N、O分别与H形成的简单化合物中熔点最高的是 (填化合物化学式),试解释原因 。
(4)已知NaNO2 能发生如下反应(未配平):NaNO2 + HI → NO + I2 + NaI + H2O当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
(5)有人将26中反应产生的NO收集到一个固定容积的密闭容器中,并在常温下将其压缩到1.01×107 Pa,然后加热至50℃时,发现气体的压力迅速下降。当温度恢复到常温,压强降至略小于1.01×107 Pa的2/3时,就不再改变。已知此过程中有一种产物是N2O。请写出生成N2O的反应方程式: 。
解释最后的气体压强略小于1.01×107 Pa的2/3原因: 。
(6)某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染,下列试剂中①NaCl、②
NH4Cl、③HNO3、④浓H2SO4,能使NaNO2转化为N2的是 。(选填编号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com