
【题目】当溶液中X2O72-和SO32-的离子数之比为1:3时正好完全发生氧化还原反应,X在还原产物中的化合价为( )
A.+2B.+3C.+4D.+5
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】甲醇(沸点65℃)是一种可再生能源,具有广泛的开发和应用前景。
(1)常温下,1g甲醇完全燃烧生成液态水时放出22.7kJ的热量,写出表示甲醇燃烧热的热化学方程式 ________________________________________________。
(2)现有反应CO(g)+2H2(g) =CH3OH(g)过程中能量变化如图所示,写出该反应的热化学方程式_______________________________;
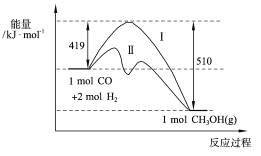
该反应在不同温度下的化学平衡常数 K(250℃)____K(350℃)(填“大于”或“小于”),
若恒温恒容下,将3molCO和6molH2充入密闭容器中进行该反应,反应达到平衡,测得容器内压强为开始时的0.6倍,CO的转化率为_______。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH- =2CO32-+6H2O,则负极的电极反应式为:________________________。
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:_____________;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH-物质的量浓度为0.01 molL-1(25℃下测定),则理论上消耗氧气的体积为_________mL(标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过査阅资料找到一种废钒催化剂的回收工艺流程路线如下:

可答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则V2O5转化为VO2+ 的离子方程式为______________。 “废渣1”的主要成分是_______。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式_______________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有_____________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH 为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是___________;为了提高洗脱效率,淋洗液应该呈____________性(填“酸”、“碱”或“中”)。
R4V4O12+4OH-(ROH 为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是___________;为了提高洗脱效率,淋洗液应该呈____________性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉淀的化学方程式__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如图所示,其中充满NO2的试管是( )。
A. 
B. 
C. 
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,下列有关说法正确的是
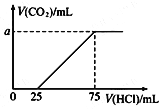
A. 原溶液中NaOH的物质的量为0.75 mol
B. 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3
C. 通入CO2后所得的溶液中含有2.5×10-3 mol NaHCO3
D. 纵坐标中a的数值为224
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝有多重优良性能,因而有极为广泛的用途。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3,等杂质)为原料制备铝的一种工艺流程如图所示

下列说法不正确的是
A. “电解Ⅰ”的电解过程中作阳极的石墨易消耗
B. “电解Ⅱ”阴极区溶液pH变大
C. 理论上每生成1molAl,会有0.75molO2产生
D. “电解Ⅱ”阳极的电极反应式为4CO32-+2H2O-4e-=4HCO3-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TK时,向2.0L恒容密闭容器中充入0.10molCOCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g)经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是:
Cl2(g)+CO(g)经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是
A. TK时该反应的化学平衡常数为1/75
B. 反应在前2s的平均速度v(CO)=0.015mol·L-1·s-
C. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022molL-1,则反应的△H<0
D. 平衡后向上还容器中再充入0.10molCOCl2,平衡正向移动,COCl2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO![]() →Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是( )
→Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是( )
A. Fe3+ B. MnO![]() C. Cl2 D. HNO2
C. Cl2 D. HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应式:①Fe+Cu2+═Fe2++Cu ②2Fe3++Cu═2Fe2++Cu2+可判断离子的氧化性从强到弱的顺序是( )
A. Fe2+、Fe3+、Cu2+ B. Fe2+、Cu2+、Fe3+
C. Cu2+、Fe2+、Fe3+ D. Fe3+、Cu2+、Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com