
【题目】某溶液X中可能含有下列离子中的若干种:NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-为了确定该溶液的组成,某同学取上述溶液X,进行了如下实验:
(1)向一定量溶液X加入少量氯水,然后滴加淀粉溶液,未显蓝色;
(2)另取100毫升溶液X再加入足量氯水,然后滴加足量BaCl2溶液,得到沉淀6.99g;
(3)将上述(2)的反应混合液过滤,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为2.24L。
根据上述实验,以下推测正确的是
A.原溶液可能存在Na +、Fe3+、SO42-
B.原溶液一定存在NH4+、I-
C.原溶液一定不含Ba2+、Fe3+、I-
D.另取X试液滴加足量盐酸酸化的BaCl2溶液,即可确定溶液所有的离子组成
【答案】B
【解析】
由(2)可知溶液中必定存在SO32-或SO42-物质的量之和为![]() ,由(3)可知必定存在NH4+,物质的量为
,由(3)可知必定存在NH4+,物质的量为![]() ,结合溶液中电荷守恒和离子共存分析。
,结合溶液中电荷守恒和离子共存分析。
由(2)可知溶液中必定存在SO32-或SO42-物质的量之和为![]() ,由(3)可知必定存在NH4+,物质的量为
,由(3)可知必定存在NH4+,物质的量为![]() ,根据电荷守恒可知溶液中必定存在至少0.04molI-,由(1)可知溶液中存在SO32-;Fe3+与I-不共存,必定不存在;Ba2+与SO32-不共存,必定不存在,Na+和SO42-可能存在,
,根据电荷守恒可知溶液中必定存在至少0.04molI-,由(1)可知溶液中存在SO32-;Fe3+与I-不共存,必定不存在;Ba2+与SO32-不共存,必定不存在,Na+和SO42-可能存在,
A.原溶液可能存在Na +、SO42-,Fe3+必定不存在,故A错误;
B. 原溶液一定存在NH4+、I-,故B正确;
C. 原溶液一定不含Ba2+、Fe3+,I-一定存在。故C错误;
D. 另取X试液滴加足量盐酸酸化的BaCl2溶液,只能确定验证 SO42-的存在,无法确定Na +是否存在,故D错误;
故答案选:B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某工厂废液经测定得知主要含有乙醇,其中还含有丙酮、乙酸和乙酯乙酯。根据下表中各物质的性质,按下列步骤回收乙醇和乙酸。
已知:乙酸乙酯在碱性条件下水解生成乙酸钠和乙醇。
物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
沸点/℃ | 56.2 | 77.06 | 78.5 | 117.9 |
①向废液中加入烧碱溶液,调整溶液的pH=10;②将混合液放入蒸馏器中缓缓加热;③收集温度在70~85℃时的馏出物;④排出蒸馏器中的残液,冷却后向其中加浓硫酸(过量),然后再放入耐蒸馏器中进行蒸馏,回收馏出物。请回答下列问题:
(1)加入烧碱使溶液的pH=10的目的是_______________________。
(2)在70~85℃时馏出物的主要成分是________。
(3)在步骤④中加入过量浓硫酸的目的是(用化学方程式表示)_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.溴化亚铁溶液中通少量的氯气:2Br-+ Cl2=== 2Cl-+ Br2
B.氢氧化铁悬浊液溶于氢碘酸溶液中:2Fe(OH)3+6H++2I- = 2Fe2++I2+6H2O
C.碳酸氢钙与少量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D.稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(18分)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
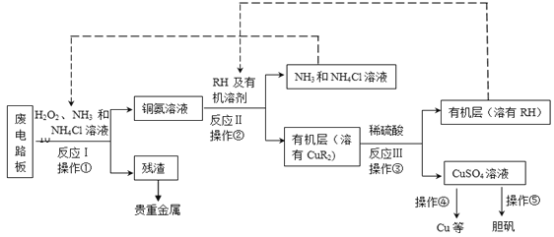
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,反应中H2O2的作用是 。写出操作①的名称: 。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,写出该反应的离子方程式: 。操作②用到的主要仪器名称为 ,其目的是(填序号) 。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度
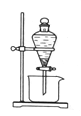
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和 。若操作③使用下图装置,图中存在的错误是 。
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是 。操作⑤由硫酸铜溶液制胆矾的主要步骤是 。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是 。循环使用的NH4Cl在反应Ⅰ中的主要作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酮常温下为无色晶体或浅黄色油状液体,是山楂、含羞草、紫丁香等香精的调合原料,并广泛用于皂用香精和烟草香精中,可由苯经下述反应制备:
![]() +(CH3CO)2O
+(CH3CO)2O![]()
![]() +CH3COOH
+CH3COOH
NA代表阿伏加德罗常数的值。下列有关说法正确的是
A.气态苯乙酮的密度是气态乙酸密度的2倍
B.1mol苯所含的化学单键数目为12 NA
C.0.5mol乙酸酐中含有的电子数目为27 NA
D.1L2mol/LCH3COOH溶液与足量钠反应生成的气体分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)汽车尾气脱硝脱碳主要原理为2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) ΔH <0。
N2(g) + 2CO2(g) ΔH <0。
①该反应在______(填“低温”或“高温”)下可自发反应。
②一定条件下的密闭容器中,充入10 mol CO和8 mol NO, 发生上述反应,如图为平衡时NO的体积分数与温度、压强的关系。

Ⅰ.该反应达到平衡后,为在提高反应速率同时提高NO的转化率,可采取的措施有______(填字母序号)。
a.缩小容器的体积 b.改用高效催化剂
c.升高温度 d.增加CO的浓度
Ⅱ.压强为10 MPa、温度为T1下,若反应进行到30 min达到平衡状态,容器的体积为4L,该温度下平衡常数Kp=______(压强以MPa为单位进行计算,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
③氨气易溶于水可电离出 NH4+和 OH-、易液化,液氨也与水一样发生微弱的双聚电离,但比水弱,能溶解一些金属等性质。下列说法中不正确的是_______
a.NH3 可看作比水弱的电解质
b.NH3 的双聚电离可表示为:2NH3![]() NH4++NH2-
NH4++NH2-
c.NH3 易溶于水是由于与水形成氢键
d.NH3 可与Na 反应: 2NH3+2Na=2NaNH2+H2↑
(2)冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放。用活性炭处理工厂尾气中的氮氧化物。
①已知:Ⅰ. 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1=a kJ·mol-1
Ⅱ. 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2=b kJ·mol-1
Ⅲ. C(s)+O2(g)=CO2(g) ΔH3=c kJ·mol-1
则反应C(s)+2NO(g) ![]() N2(g)+CO2(g)的ΔH =_____ kJ·mol-1(用a、 b 、c表示)。
N2(g)+CO2(g)的ΔH =_____ kJ·mol-1(用a、 b 、c表示)。
②在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH=Q kJ·mol-1,平衡时c(NO)与温度T的关系如图所示,下列说法正确的是______。
N2(g)+CO2(g) ΔH=Q kJ·mol-1,平衡时c(NO)与温度T的关系如图所示,下列说法正确的是______。
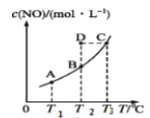
a.其他条件不变,容器内压强不再改变时,反应达到平衡状态
b.温度为T2时,若反应体系处于状态D,则此时v正>v逆
c.该反应的Q>0,所以T1、T2、T3对应的平衡常数:K1<K2<K3
d.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)
③已知某温度时,反应C(s)+2NO(g) ![]() N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图中画出反应过程中c(NO)随时间t的变化曲线。
N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图中画出反应过程中c(NO)随时间t的变化曲线。
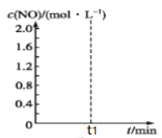 ____________
____________
④工业上实际处理废气时,常用活性炭作催化剂,用NH3还原NO,同时通入一定量的O2以提高处理效果。当n(NH3)=n(NO)时,写出体系中总反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法净化水过程如图所示。下列说法中错误的是

A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的![]() 、
、![]() 、Cl通过阴离子树脂后被除去
、Cl通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]()
B. Na+的结构示意图:![]()
C. Ge的电子排布式:[Ar]3d104s24p2
D. Cu+的价电子排布式:3d10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢是一种急性剧毒气体,回收硫化氢解决了环境污染问题也可变废为宝。其反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) △H=-632 kJ·mol-1。在酸性固体电解质环境下,硫化氢的处理原理图如图所示。下列说法正确的是

A.电极a的电极反应式为2H2S-4e-=S2+4H+
B.电子由电极a经质子固体电解质膜流向电极b
C.1 mol的H2S气体完全反应得到固体S2和水蒸气放热316kJ
D.负载中电流的方向自上而下
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com