
分析 (1)弱酸的电离方程式书写用可逆号;
(2)HNO2能氧化Fe2+生成Fe2+和NO,据电子守恒书写离子方程式;HNO2氧化KI的反应中生成NO和碘单质;
(3)检验工业盐和食盐,可以利用亚硝酸的氧化性检验;在反应Pb+NaNO3$\frac{\underline{\;高温\;}}{\;}$PbO+NaNO2中,每生成1molNaNO2转移2mol电子,当转移4NA个电子即4mol电子时生成2moNaNO2,据此分析.
解答 解:(1)亚硝酸是弱酸,其电离方程式为HNO2?H++NO2-,故答案为:HNO2?H++NO2-;
(2)HNO2能氧化Fe2+生成Fe2+和NO,在酸性条件下的离子方程式为,2H++NO2-+Fe2+=Fe3++NO+H2O;HNO2氧化KI的反应中生成NO和碘单质每生成1molNO转移1mol电子,生成1molI2转移2mol电子,据电子守恒,氧化产物与还原产物的物质的量之比为1:2,
故答案为:2H++NO2-+Fe2+=Fe3++NO+H2O;1:2;
(3)HNO2能氧化Fe2+、I-、SO32-,还原产物是一种无色气体,该气体遇空气变为红棕色,检验工业盐和食盐时,可以用酸性KI溶液,能够生成红棕色气体的为工业盐;在反应Pb+NaNO3$\frac{\underline{\;高温\;}}{\;}$PbO+NaNO2中,每生成1molNaNO2转移2mol电子,当转移4NA个电子即4mol电子时生成2moNaNO2,质量为138g,
故答案为:酸性KI溶液;138.
点评 本题考查了弱电解质的电离方程式书写、氧化还原方程式书写以及电子守恒的计算,题目难度不大,注意电子守恒的应用.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | AgNO3溶液 | C. | NaOH溶液 | D. | BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠在水中的电离:NaHCO3═Na++H++CO32- | |
| B. | 钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 氯气和水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 铝和烧碱溶液的反应:Al+2OH-═AlO-2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
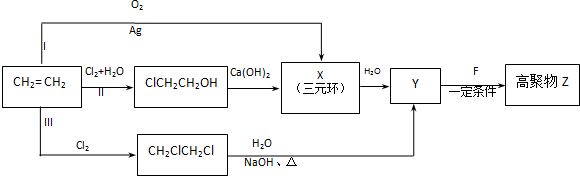
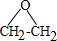 .
.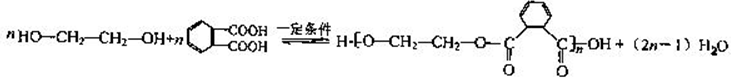 CH2ClCH2Cl→Y:CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl.
CH2ClCH2Cl→Y:CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
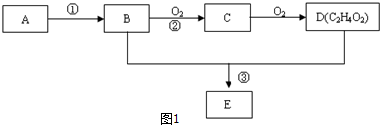
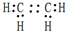 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.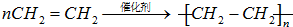 ,反应类型是加聚反应.
,反应类型是加聚反应.
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
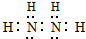 .
. HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com