
| A. | 向50 mL 1 mol•L-1的盐酸中加入烧碱,水的KW不变 | |
| B. | NH4Cl和NH3•H2O混合液中,二者对对方的平衡都起了抑制作用 | |
| C. | 有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+) | |
| D. | 常温下0.1mol•L-1的HA溶液中c(OH-)/c(H+)=10-8,则0.01 mol•L-1HA溶液中c(H+)=1×10-4mol•L-1 |
分析 A.酸碱中和为放热反应,溶液温度升高,促进水的电离;
B.依据电离平衡和盐类水解平衡的影响因素分析;
C.酸性越强,对应离子的水解程度越弱,则溶液中该酸根离子的浓度越大;
D.根据c(OH-)/c(H+)=10-8,结合水的离子积常数计算氢离子浓度,判断该酸是弱酸,然后根据弱酸稀释的规律解题.
解答 解:A.Kw只受温度的影响,盐酸中加入烧碱发生酸碱中和反应,放出热量,使体系温度升高,Kw值增大,故A错误;
B.铵根离子水解方程式:NH4++H2O?NH3•H2O+H+加入一水合氨,一水合氨浓度增大,平衡向逆向移动,抑制铵根离子的水解;一水合氨的电离方程式:NH3•H2O?NH4++OH-,加入氯化铵溶液,铵根离子浓度增大,平衡向逆向移动,抑制了一水合氨的电离,故B正确;
C.两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中,NaX的水解程度小于NaY,则c(X-)>c(Y-),溶液中离子浓度大小为:c(X-)>c(Y-)>c(OH-)>c(H+),故C错误;
D.c(OH-)/c(H+)=10-8,c(OH-)×c(H+)=1×10-14,则c(H+)=10-3mol•L-1,该酸为弱酸,加水稀释时弱酸的电离程度增大,所以0.01 mol•L-1 HA溶液中c(H+)>1×10-4mol•L-1,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及弱电解质的电离平衡和盐类水解平衡的影响因素等知识,为高考的热点,侧重于学生的分析能力的考查,注意掌握盐类水解的特点以及影响电解质的电离平衡的因素.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
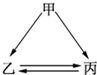 如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )| A. | ①②③⑤ | B. | ②③④⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | CO2的水溶液:c(H+)>c(HCO3-)═2c(CO32-) | |
| C. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
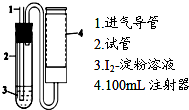 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如下:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制蒸馏水 | |
| B. | 粗盐提纯 | |
| C. | 用氢气还原氧化铜 | |
| D. | 用氯化钠晶体配制100mL0.1mol•L-1的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液 | |
| B. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变升高温度,平衡时氢气转化率增大 | |
| C. | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的△S<0 | |
| D. | 为处理锅炉水垢中的 CaSO4,可先用饱和 Na2CO3 溶液浸泡,再加盐酸溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com