
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,溶液中c(OH-)增大 | |
| D. | 降低温度,溶液中c(NH4+)增大 |
分析 弱电解质的电离是吸热反应,降低温度抑制弱电解质电离,向氨水中加入酸促进一水合氨电离,加入碱抑制一水合氨电离,加水稀释促进一水合氨电离,注意电离平衡常数只与温度有关.
解答 解:A.加水稀释时,促进一水合氨电离,氢氧根 离子的物质的量增大,一水合氨的物质的量减小,所以溶液中氢氧根离子浓度与一水合氨分子浓度之比增大,故A正确;
B.向氨水中加入少量氢氧化钠,溶液中氢氧根离子浓度增大,则抑制一水合氨电离,温度不变,电离平衡常数不变,故B错误;
C.向氨水中加入少量浓盐酸,氢离子和氢氧根离子反应生成水,所以氢氧根离子浓度减小,故C错误;
D.一水合氨的电离是吸热反应,降低温度抑制其电离,则溶液中铵根离子浓度减小,故D错误;
故选A.
点评 本题考查了弱电解质的电离,明确影响弱电解质电离的因素,难度中等,注意加水稀释氨水溶液,溶液中氢离子浓度增大,为易错点.


科目:高中化学 来源: 题型:解答题
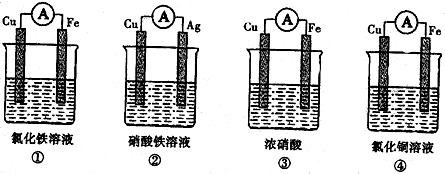
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④ | C. | ②③⑤ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
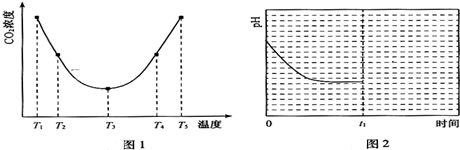
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )
如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )| ①Cu为阳极,Zn为阴极 ②Cu极上有气泡产生 ③SO42-向Cu极移动 ④若有0.5mol电子流经导线,可产生0.25mol气体 ⑤电子的流向是Cu→导线→Zn ⑥正极反应式:Cu+2e-═Cu2+ |
| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氯气所含原子数目为NA | |
| B. | 2 L 0.2 mol/L K2SO4溶液SO42-物质的量浓度为0.4 mol/L | |
| C. | 1 mol Na作还原剂可提供电子数为NA | |
| D. | 同温、同压下NA个CO2分子和NA个O2分子的体积相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com