
【题目】下列有关水在人体中的作用的说法不正确的是
A. 在人体内分解会放出热量 B. 能调节人体体温
C. 是人体内进行生化反应的介质 D. 在人体内是一种良好的溶剂
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在强酸性溶液中一定能大量共存的是( )
A.Na+、Cl﹣、SO42﹣、NH4+
B.Fe3+、Ag+、CO32﹣、Cl﹣
C.Mg2+、K+、AlO2﹣、HCO3﹣
D.Na+、Fe2+、ClO﹣、MnO4﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其工作原理如图所示。下列说法中不正确的是

A. 电池放电时Na+从a极区移向b极区
B. 燃料电池是一类能量转化效率高、环境友好的发电装置
C. 该电池的负极反应为BH4-+ 8OH-一8e-═BO2-+ 6H2O
D. 在电池反应中,每消耗3molH2O2,转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故处理方法正确的是( )
A. Na着火时,立即用水灭火
B. 实验室不小心碰翻酒精灯引起实验桌上洒落的少量酒精起火时,迅速用泡沫灭火器灭火
C. 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
D. 浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(1)反应生成的CH3COONa显_________f性,用离子方程式解释原因:____________,则实验中应选用上表中的__________作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:_________________。
(3)第一次滴定前后,碱式滴定管中的液面位置如右图所示,请将有关数据填入下面表格的空白处。

滴定次数 | 待食用白醋的体积/mL | 0.1000 mol/L NaOH溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | ______ | _______ | ________ |
第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显多于其余两次,其原因可能是________。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
C.第二次滴定用的锥形瓶用待装液润洗过
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化合物的名称或结构简式:
①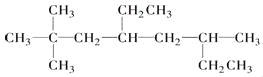 的名称为________________________.
的名称为________________________.
②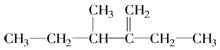 的名称为______________________________.
的名称为______________________________.
③2,5-二甲基-2,4-己二烯的结构简式:__________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO+H2O(g)CO2+H2在1000K达到平衡时,分别改变下列条件,K值发生变化的是( )
A.将压强减小至原来的一半
B.添加催化剂
C.将反应温度升高至1200 K
D.增大水蒸气的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物对人类的生产和生活有着重要的作用。
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
已知:O2(g)+2C(s)=2CO(g) ΔH=-221kJ·mol-1,
写出O2氧化Ba(s)和S(s)至BaSO4的热化学方程式___________________。
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
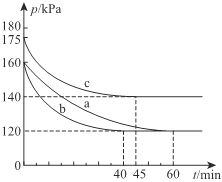
①与实验a相比,c组改变的实验条件可能是______________,判断的依据是______________________。
②用P0表示开始时总压强,P表示平衡时总压强,用α表示SO2的平衡转化率,则α的表达式为______________________。
(3)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH=-42kJ·mol-1。
SO3(g)+NO(g) ΔH=-42kJ·mol-1。
在1 L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如下:
实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T2 | 0.20 | 0.30 | a |
①实验甲中,若2 min 时测得放出的热量是4.2 kJ,则0~2 min时间内,用SO2 (g)表示的平均反应速率υ(SO2)=__________,该温度下的平衡常数为______________。
②实验丙中,达到平衡时,NO2的转化率为_______________。
③由表中数据可推知,T1_____T2(填“>”“<”或“=”),判断的理由是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com