
下列各离子组在指定的溶液中一定能大量共存的是 ( )
①常温在C(H+)/C(OH-)= 10-10溶液中:K+、Na+、CH3COO-、SO42﹣
②常温pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③水电离出的H+浓度c(H+)=10﹣12mol•L?1的溶液中:Cl﹣、NO3﹣、Na+、S2O32﹣
④使甲基橙变红色的溶液中:Fe3+、NO3﹣、Na+、SO42﹣
A.①②③ B.①②④ C.②③④ D.①③④
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:2016-2017学年天津市高一上期末化学卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.少量的钠投入 Ca( HCO 3 ) 2 溶液中:2Na+2Ca2++2HCO3-=2Na++2CaCO3↓+H2↑
B.硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.大理石与醋酸溶液反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.向 Ba(OH ) 2 溶液中逐滴加入 NH4HSO4 溶液直至过量:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:选择题
在某温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示.则下列结论正确的是
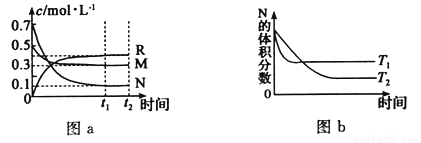
A.该反应的热化学方程式M(g)+3N(g) 2R(g)△H>0
2R(g)△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:实验题
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再进行测定。
(1)在高温下将x克钢样中碳、硫转化为CO2、SO2(气体a)。
(2)将气体a通入测硫装置中(如图1),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:___________ ______。
②将①的吸收液稀释至250mL,取1/10该溶液进行滴定,用酸式滴定管取液时赶走气泡的操作是_ 。
③用c mol/L 标准 NaOH 溶液滴定取出的溶液,则选择的指示剂为_________,直至加入最后一滴NaOH溶液时,溶液颜色_________,即可停止滴定。
④某次滴定前后,NaOH 溶液的液面如图2,其体积读数为________________________。若滴定3次,消耗NaOH溶液体积的平均值为z mL,则该钢样中硫的质量分数为______________________(用 x、c、z表示)。
⑤下列操作会造成测定结果偏高的是__________。
a.水洗后未用标准液润洗碱式滴定管 b.加入1 mL酸碱指示剂
c.滴定终点时,尖嘴出现气泡 d.滴定终点俯视滴定管的刻度
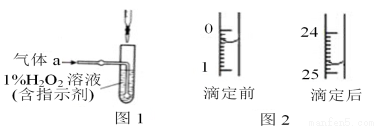
将气体 a 通入测碳装置中(如图),采用重量法测定碳的含量。

⑥为准确测定CO2,需除去SO2的干扰,除去SO2的装置是_______(填序号)。
⑦计算钢样中碳的质量分数,应测量的数据是__________。去掉装置E,测得碳的质量分数 (填 “偏小”、“无影响”或“偏大”)
⑧上述操作中,测定CO2前先除去SO2,但测定SO2前却没除CO2,是否合理?若不合理,说明如何改正;若合理,说明理由_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
下列有关方程式书写正确的是( )
A.醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-=H2O
B.H2S在水溶液中的电离:H2S+H2O H3O++ HS-
H3O++ HS-
C.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4 (g)+2O2 (g) == CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+H+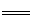 I2+ 2H2O
I2+ 2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
可逆反应∶2NO2 2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
A.CH4与CH2Cl2均为正四面体 B.BeCl2与SO2为直线形
C.BF3与PCl3为三角锥形 D.NO3—与CO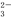 为平面三角形
为平面三角形
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
在逻辑上概念之间存在如图所示关系。对下列概念之间关系的说法正确的是

A.纯净物与混合物属于包含关系
B.化合物与氧化物属于交叉关系
C.单质与化合物属于并列关系
D.氧化反应与化合反应属于并列关系
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三上质检二化学卷(解析版) 题型:实验题
某化学兴趣小组在实脸室模拟侯德榜制碱法制备纯碱。主要步骤如下:
第一步:配制饱和NaCl溶液,倒入烧杯中加热;
第一步:控制温度在30-35 ℃。边搅拌边分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟;
第三步:静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,然后抽干;
第四步:将第二步所得固体转入蒸发皿中,灼烧2小时,制得纯碱固体,
已知:温度高于35℃时,NH4HCO3会分解。有关盐的溶解度(g/100g水)如下表:
盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —— | —— | —— | —— |
NaHC | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | —— |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
回答下列问题:
(1)反应温度控制在30-35℃范围内,应采取的加热方法为 ,反应温度不能高于35℃的理由是 .
(2)第三步静置后析出NaHCO3晶体的原因是 ;用蒸馏水洗涤NaHCO3晶体的目的是除去杂质粒子 (用离子符号表示)。
(3)若向过滤所得母液中加入 (填写试剂名称),并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)纯碱产品不纯,含有NaHCO3、NaCl等杂质。测定纯碱中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加l-2滴酚酞指示剂,用物质的量浓度为cmol/L的盐酸滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点), 所用盐酸体积为V1mL,再加1-2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄变橙,所用盐酸总体积为V2m L。
L。
① 实验室配制一定体积cmol/L盐酸需用 的仪器除了容量瓶、烧杯、量筒外还需 ;在容量瓶的使用方法中,下列操作正确的是 (填写标号)
的仪器除了容量瓶、烧杯、量筒外还需 ;在容量瓶的使用方法中,下列操作正确的是 (填写标号)
a.使用容量瓶前检验它是否漏水
b.容量瓶用蒸馏水洗净后,再用待配溶液润洗
c.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中.然后加蒸馏水定容
d.用容量瓶把溶液配制完成以后.直接贴上标签,放置备用
e.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次
② 写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3 (%)= 。
(%)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com