
【题目】连二亚硫酸钠![]() 又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验。
又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验。
Ⅰ.查阅材料
i.连二亚硫酸钠![]() 是一种白色粉末,易溶于水,难溶于乙醇。
是一种白色粉末,易溶于水,难溶于乙醇。
ii.![]()
iii.![]()
II.制备方法
![]() ℃时将甲酸钠和纯碱加入乙醇水溶液中,通入
℃时将甲酸钠和纯碱加入乙醇水溶液中,通入![]() 进行反应,完成其反应方程式:_____
进行反应,完成其反应方程式:_____![]() ______
______ ![]() ______ = ______
______ = ______ ![]() ______
______ ![]() ____,冷却至40℃~45℃,过滤,用 ______ 洗涤,干燥制得
____,冷却至40℃~45℃,过滤,用 ______ 洗涤,干燥制得![]() ;
;
III.![]() 的性质
的性质
(1)![]() 溶液在空气中易被氧化,课题小组测定
溶液在空气中易被氧化,课题小组测定![]()
![]()
![]() 溶液在空气中pH变化如图:
溶液在空气中pH变化如图:![]() 段主要生成
段主要生成![]() ,根据pH变化图,
,根据pH变化图,![]() 的电离平衡 ______ 水解平衡
的电离平衡 ______ 水解平衡![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,课题小组推测
,课题小组推测![]() 溶液在空气中易被氧化,
溶液在空气中易被氧化,![]() 发生离子反应方程式为 ______
发生离子反应方程式为 ______ ![]() 时溶液中主要阴离子符号是 ______ 。
时溶液中主要阴离子符号是 ______ 。
(2)隔绝空气加热![]() 固体完全分解得到固体产物
固体完全分解得到固体产物![]() 、
、![]() 和气体为 ______
和气体为 ______ ![]() 填化学式
填化学式![]() 请你设计实验验证产物有
请你设计实验验证产物有![]() 存在,完成下表中内容.
存在,完成下表中内容.![]() 供选择的试剂:稀盐酸、稀硝酸、
供选择的试剂:稀盐酸、稀硝酸、![]() 溶液、
溶液、![]() 溶液
溶液![]()
实验步骤 | 预期的实验现象和结论 |
________ | ________ |

【答案】1 ![]() 2 3 乙醇
2 3 乙醇 ![]()
![]()
![]()
![]() 取少量完全分解的固体产物于试管中,加入稀盐酸 若有淡黄色沉淀,则有
取少量完全分解的固体产物于试管中,加入稀盐酸 若有淡黄色沉淀,则有![]() 存在
存在
【解析】
II.根据电子得失守恒和原子守恒书写化学方程式;连二亚硫酸钠是一种白色粉末,易溶于水,难溶于乙醇;
III.(1)溶液显酸性,![]() 的电离程度大于水解程度;
的电离程度大于水解程度;![]() 溶液在空气中易被氧化生成亚硫酸氢钠,t3时溶液的
溶液在空气中易被氧化生成亚硫酸氢钠,t3时溶液的![]() ,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠;
,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠;
(2)隔绝空气加热![]() 固体完全分解,得到固体产物
固体完全分解,得到固体产物![]() 、
、![]() 和气体,其中亚硫酸钠是氧化产物,而
和气体,其中亚硫酸钠是氧化产物,而![]() 中S是+2价,则根据氧化还原反应中电子得失守恒可知气体应该是
中S是+2价,则根据氧化还原反应中电子得失守恒可知气体应该是![]() ,根据反应
,根据反应![]() 可知要检验硫代硫酸钠。
可知要检验硫代硫酸钠。
II.反应中S元素的化合价从![]() 价降低到
价降低到![]() 价,得到1个电子,甲酸钠中碳元素的化合价从+2价升高到+4价,则根据电子得失守恒和原子守恒可知反应的化学方程式为:
价,得到1个电子,甲酸钠中碳元素的化合价从+2价升高到+4价,则根据电子得失守恒和原子守恒可知反应的化学方程式为:![]() ,连二亚硫酸钠是一种白色粉末,易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品,
,连二亚硫酸钠是一种白色粉末,易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品,
故答案为:2;1;4SO2;2;3;H2O;乙醇;
III.(1)![]() 溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生离子反应方程式为:
溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生离子反应方程式为: ![]() ,t1段主要先生成
,t1段主要先生成![]() ,溶液显酸性,
,溶液显酸性,![]() 的电离程度大于水解程度;t3时溶液的
的电离程度大于水解程度;t3时溶液的![]() ,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠,则溶液中主要阴离子符号是
,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠,则溶液中主要阴离子符号是![]() ,
,
故答案为:![]() ;
;![]() ;
;![]() ;
;
(2)隔绝空气加热![]() 固体完全分解,得到固体产物
固体完全分解,得到固体产物![]() 、
、![]() 和气体,其中亚硫酸钠是氧化产物,而
和气体,其中亚硫酸钠是氧化产物,而![]() 中S是
中S是![]() 价,则根据氧化还原反应中电子得失守恒可知气体应该是
价,则根据氧化还原反应中电子得失守恒可知气体应该是![]() ;根据反应
;根据反应![]() 可知,要检验硫代硫酸钠,则只需要取少量完全分解的固体产物于试管中,加入稀盐酸,若有淡黄色沉淀,则有
可知,要检验硫代硫酸钠,则只需要取少量完全分解的固体产物于试管中,加入稀盐酸,若有淡黄色沉淀,则有![]() 存在,
存在,
故答案为:![]() ;取少量完全分解的固体产物于试管中,加入稀盐酸;若有淡黄色沉淀,则有
;取少量完全分解的固体产物于试管中,加入稀盐酸;若有淡黄色沉淀,则有![]() 存在。
存在。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】回收利用硫和氮的氧化物是环境保护的重要举措。
(1)已知:2NO(g ) + O2(g)![]() 2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
第一步:2NO(g ) ![]() N2O2(g) △H1 =-a kJmolˉ1 (快反应)
N2O2(g) △H1 =-a kJmolˉ1 (快反应)
第二步:N2O2(g ) + O2(g)![]() 2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
①下列对上述反应过程表述正确的是__________(填标号)。
A.NO比N2O2稳定
B.该化学反应的速率主要由第二步决定
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度为0时反应达到平衡
②该反应逆反应的活化能为_______________。
(2)通过下列反应可从燃煤烟气中回收硫。2CO(g) + 2SO2(g)![]() 2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:

①与实验a相比,实验b改变的实验条件可能是______________________。
②实验b中的平衡转化率a(SO2)=_________。
(3)用NH3消除NO污染的反应原理为: 4NH3 + 6NO![]() 5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
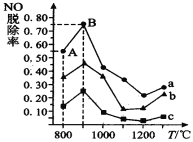
①曲线c对应NH3与NO 的物质的量之比是_______________。
②曲线a中 NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________ mg/(m3s)。
(4)双碱法除去SO2是指:用 NaOH 吸收SO2,并用CaO使 NaOH再生。NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
①用化学方程式表示NaOH 再生的原理____________________________________ 。
②25℃ 时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、 NaHSO3的混合溶液,且溶液恰好呈中性,则该混合溶液中各离子浓度由大到小的顺序为_____________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的反应和实验装置如下:
SO2(g)+Cl2(g) ![]() SO2Cl2(l) ΔH=- 92.7 kJ/mol
SO2Cl2(l) ΔH=- 92.7 kJ/mol
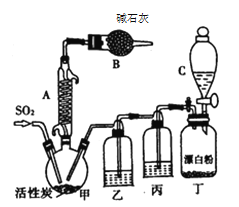
有关信息如下:硫酰氯通常条件下为无色液体,熔点为-54.1 ℃,沸点为69.1 ℃,密度为1.67g /cm3,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。回答下列问题:
(1)装置甲中仪器A的名称为___________,甲中活性炭的作用是________,B的作用为_________;
(2)装置丁中发生反应的离子方程式为__________________________;
(3)装置丙中的试剂为____________________,若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为_______________________________________;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_______(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)本实验中通入SO2的体积为11.2 L(已折算成标准状况),Cl2充足,实验最终收集到硫酰氯27.0 mL,则硫酰氯的产率为_________________(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)H3CuCl4(aq).
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO![]() +4H+
+4H+
CuCl43﹣(aq)CuCl(s)+3Cl﹣(aq)
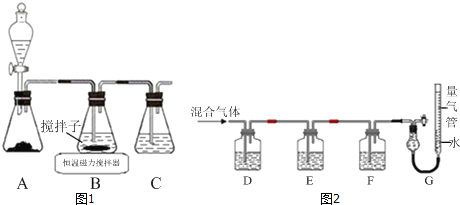
①装置C的作用是_____.
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物![]()
![]()
![]()
![]()
![]() CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____.
③实验室保存新制CuCl晶体的方法是_____.
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____.
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)ClH2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____、_____.
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )
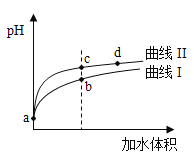
A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中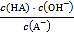 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。
(1)现有一种无色的鲜花营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。
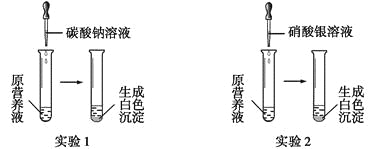
根据以上实验,请你填空。
①由实验1可确定原营养液中一定没有的物质是__________(填化学式),写出生成白色沉淀的离子方程式是________________________。
②若测得原营养液中K+、Cl-的数目之比为2∶1,则原营养液是由____种溶质配制成的。
③某同学用氯化钙、硝酸钾、氯化钾配成的营养液中K+、Cl-、NO3-的数目之比为2∶5∶1,则所用硝酸钾和氯化钙的物质的量之比是__________。
(2)下表是500mL某“鲜花保鲜剂”中含有的成分,阅读后回答下列问题。
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 68.4 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
①“鲜花保鲜剂”中蔗糖的物质的量浓度为___________________。
②配制该500mL “鲜花保鲜剂”所需的玻璃仪器除了烧杯、玻璃棒、量筒外还有________。
③在溶液配制过程中,下列操作能使配制结果偏小的是___________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.移液时,液体不小心从外壁流出
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.金属的晶胞如图所示 ,其配位数为8
,其配位数为8
B.![]() 分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为
分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为![]() 杂化,是直线型分子
杂化,是直线型分子
C.醋酸钠溶液中离子浓度的关系为:![]()
D.已知反应![]() ,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量
,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量![]() ,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:
,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:![]()
物质 |
|
|
|
浓度 |
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
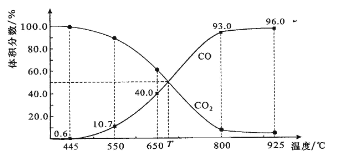
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,不能得出相应实验结论的是
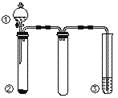
选项 | ① | ② | ③ | 实验结论 |
A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | Fe | NaOH溶液 | 说明铁和浓硝酸反应可生成NO2 |
D | 浓氨水 | 生石灰 | 酚酞 | 氨气的水溶液呈碱性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com