
【题目】Ⅰ:为使空气质量达标,完成二氧化硫,氮氧化物排放量下降的目标,离不开各种化学处理方法。一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO3(g)△H=-296kJ·mol-1
SO3(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是___________________。
Ⅱ:如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
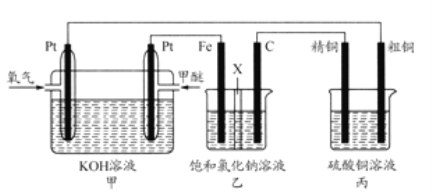
(1)甲醚燃料电池的负极反应式____________。
(2)石墨电极(C)的电极反应式为____________________________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____________(填“增大”“减小”或“不变”)。
(4)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为____________;则乙装置中生成标况下气体的体积为____________。
【答案】 2CO(g)+SO2(g)=2CO2(g)+S(l)△H=-270kJ/mol CH3OCH3-12e-+16OH-=2CO32-+11H2O 2Cl--2e-=Cl2↑ 减小 12.8g 8.96L
【解析】Ⅰ:根据盖斯定律可以写出该反应的热化学方程式。
Ⅱ:(1)燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,据此可以写出正负极极反应方程式。
(2) 甲醚燃料电池中,通入甲醚的一极为原电池的负极,与之相连的为电解池的阴极;通入氧气一极为原电池的正极,与之相连的为电解池的阳极;铁电极连接原电池的负极,为电解池的阴极,石墨为阳极,氯离子放电被氧化生成氯气。
(3)粗铜含有锌、银等杂质, 粗铜的精炼过程中,锌失电子进入溶液中,铜离子得电子在阴极析出,溶液中铜离子浓度减小,当铜失电子进入溶液后,溶液中铜离子浓度才会保持不变。
(4)根据原电池、电解池的各极反应关系,以及串联电池中转移电子数相等规律,找出相关物质间的关系O2—Cu-2H2-2Cl2,进行相关计算。
Ⅰ:根据盖斯定律:第一个反应减去第二个反应整理得出CO 处理燃煤烟气的热化学方程式:2CO(g)+SO2(g)=2CO2(g)+S(l)△H=-270kJ/mol ;正确答案:2CO(g)+SO2(g)=2CO2(g)+S(l)△H=-270kJ/mol。
Ⅱ:(1)燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极,负极上甲醚失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为: CH3OCH3-12e-+16OH-=2CO32-+11H2O ;正确答案:CH3OCH3-12e-+16OH-=2CO32-+11H2O。
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为: 2Cl--2e-=Cl2↑ ;正确答案: 2Cl--2e-=Cl2↑。
(3)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌失电子进入溶液,阴极上析出铜离子,阳极电极方程式分别为Zn-2e-=Zn2+、Cu-2e-=Cu2+,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小;正确答案:减小。
(4) 丙装置为粗铜的精炼,阴极铜离子得电子生成铜;根据串联电池中转移电子数相等得氧气和铜的关系式为:O2—2Cu,已知氧气的量为2.24/22.4=0.1mol,所以析出铜的量为0.2 mol,质量0.2×64=128g;乙装置中为电解饱和食盐水,阴极生成氢气,阳极产生氯气;根据串联电池中转移电子数相等得氧气、氢气和氯气的关系式为: O2—2H2-2Cl2,已知氧气的量为2.24/22.4=0.1mol,所以氢气的量为0.2 mol,氯气的量为0.2 mol,则乙装置中生成标况下气体的体积为(0.2+0.2)×22.4=8.96L;正确答案:12.8g ;8.96L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示进行电化学实验,电极材料为铜和另一电极X,则以下说法中错误的是( )

A. 铜电极上既可能发生反应:Cu-2e- =Cu2+,又可能发生 Cu2++2e- =Cu
B. 该装置既可实现化学能转化成电能,又能实现电能转化成化学能
C. X电极上既可能产生H2,又可能产生O2
D. 该装置既可做电镀铜的实验,又可以研究精炼铜的原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属元素特征的叙述,正确的是
A. 金属元素的原子只有还原性,离子只有氧化性
B. 金属元素在化合物中一定显正价
C. 金属单质都可以和酸反应置换出氢气
D. 金属元素的单质在常温下均为固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单斜硫和正交硫转化为二氧化硫的能量变化图如下图,下列说法正确的是:
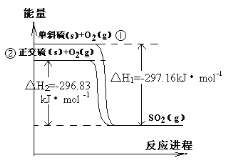
A. 单斜硫没有正交硫稳定
B. S(s,单斜)=S(s,正交) △H=+0.33 kJ· mol-1
C. 相同物质的量的正交硫比单斜硫所含有的能量高
D. ①式表示断裂l mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量少297.16 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①1 mol羟基所含电子数为10NA;
②一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液中含NH4+的物质的量小于0.5NA;
③1 mol臭氧和1.5 mol氧气含有相同的氧原子数;
④58.5 g的NaCl固体中含有NA个氯化钠分子;
⑤在反应KIO3+6HI==KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA;
⑥标准状况下,2.24 L H2O含有的分子数等于0.1NA;
⑦1 mol 乙烷分子中含有8NA个共价键;
⑧78gNa2O2中含有NA个阴离子;
⑨常温下,7.1 g Cl2与足量NaOH溶液反应转移的电子数约为0.2×6.02×1023;
⑩4.0 g重水(D2O)中所含质子数为2NA。
A. ④⑤⑦⑧⑨ B. ②③⑧⑩ C. 只有③ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年3月11日在日本发生的大地震中,福岛核电站发生了核泄漏,其周边区域的空气中漂浮着放射性物质,其中含有碘的同位素13153I,13153I中的质子数为
A. 53 B. 78 C. 131 D. 184
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学史上每一次重大发现都极大地推进了科学的发展。俄国科学家门捷列夫对化学的突出贡献在于( )
A.发现了元素周期律B.提出了原子分子学说
C.揭示了燃烧的本质D.提取了治疟药物青蒿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 物质的量是表示物质所含微观粒子多少的一个物理量
B. 物质的量的单位——摩尔,只适用于分子、原子和离子
C. 摩尔只能用来计量纯净物中微观粒子的数目
D. 摩尔不能用来计量混合气体中分子的数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
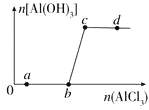
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Ag+、Ca2+、NO3-、F-
C. c点对应的溶液中:Na+、S2-、SO42-、Cl-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com