
(14分)从能量的变化和反应的快慢等角度研究反应: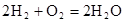 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
| A.使用催化剂 | B.提高氧气的浓度 |
| C.提高反应的温度 | D.降低反应的温度 |
| 化学键 | H—H | O=O | H—O |
键能 | 436 | 496 | 463 |
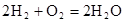 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。 (1) ABC (2)A (3)484KJ
(4)2H2 (g)+ O2(g)=2H2O(l) △H=-4QKJ/mol (5)负 氧化 2.24L
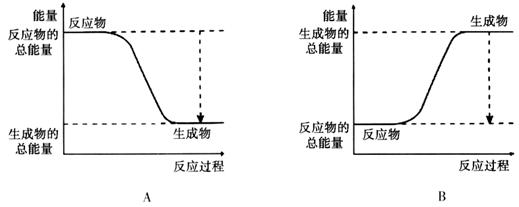
解析试题分析:(1)A. 使用催化剂可以大大加快正反应速率。正确。B. 因为氧气是反应物。提高氧气的浓度,及增大反应物的浓度,可以加快化学反应速率。正确。正确。C. 提高反应的温度。可以加快化学反应速率。正确。D. 降低反应的温度,减慢化学反应速率。错误。(2)由于已知该反应为放热反应。则反应物的能量高于生成物的能量,在发生反应时多余的能量释放出来。图像应该为A。(3)断裂化学键吸收能量,形成化学键释放能量,反应过程中的能量变化就是二者的差值,所以2molH2在氧气中燃烧生成气态水放出的热量是2mol×436kJ/mol+1mol×496 kJ/mol-4mol×463 kJ/mol=484KJ.即氧气中燃烧生成气态水的热反应方程式为2H2 (g)+ O2(g)=2H2O(g)。ΔH=-484KJ/mol. (4)因为1克氢气完全燃烧生成液态水放出QKJ的热量,所以氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+ O2(g)=2H2O(l) △H=-4QKJ/mol。(5)在氢氧燃料电池中通入氢气的电极为负极,负极发生氧化反应,n(e-)=0.2mol。则n(H2)=0.1mol. 在标准状况下消耗H2的体积是V=0.1mol×22.4L/mol=2.24L.
考点:考查影响化学反应速率的因素、反应热与键能、物质的状态及多少、原电池反应原理的知识。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:填空题
生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g) CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
(1)已知:① CH4(g)+3/2 O2(g) CO(g)+2H2O(g)△Hl;
CO(g)+2H2O(g)△Hl;
② H2(g)+1/2 O2(g) H2O(g) △H2,
H2O(g) △H2,
则CH4(g)+ H2O(g) CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
(2)一定条件下反应CH4(g)+H2O(g) CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB
CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB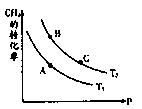
(3)维持温度T2,将0.04 mol CH4和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=____ ,下列现象能说明该反应已经达到平衡状态的是_ ___
a.容器内CH4、H2O、CO、H2的物质的量之比为1:1:1:3
b.容器的密度恒定
c.容器的压强恒定
d.3υ正(CO)=υ逆((H2)
(4)在上述B点平衡基础上,向容器中再通入amol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03mol,则a=____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢气是一种清洁、高效的新型能源。
I.用甲烷制取氢气的反应分为两步,其能量变化如下图所示: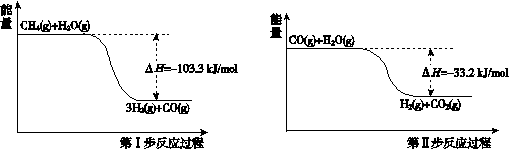
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
II.在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应。测得CO2的浓度随时间变化的图像如图: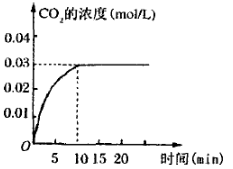
(2)在该温度下,从反应开始至达到平衡时,CO的平均反应速率为 ;
(3)该温度下,此反应的化学平衡常数为(可以用分数表示) ;
(4)下列改变中,能使平衡向正反应方向移动的是 。
| A.升高温度 | B.增大压强 |
| C.增大H2O(g)的浓度 | D.减少CO2(g)的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下: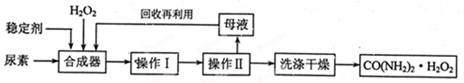
请回答下列问题:
(1)操作I、II的名称分别是______、_______。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3KJ/mol、285.8kJ/mol
②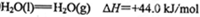
写出CH4与水蒸气作用生产CO2和H2的热化学方程式:_______________。
(3)合成过氧化氢尿素加入的稳定剂可以是水杨酸、酒石酸等。酒石酸分子式为C4H6O6,其核磁共振氢谱只有3种锋,只含羧基和羟基两种官能团,则酒石酸的结构简式为_____。
(4)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMO4溶液与尿素不反应).
①完成并配平方程式: MnO4-+
MnO4-+  H2O2+
H2O2+  _________=Mn2++
_________=Mn2++ O2↑+
O2↑+ ___;
___;
②计算出产品中H2O2的质量分数为_______。
(5)电解尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,B两极均为惰性电极。B极连接电源的____极(填
“正”或“负”),阳极电极反应方程为_____________。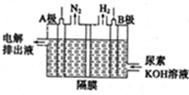
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是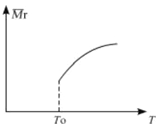
| A.该反应在任何温度下可自发进行 |
| B.若混合气体的总质量不变,表明上述反应己达到平衡状态 |
| C.其他条件不变,增大Si3N4的物质的量,平衡向左移动 |
| D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低 |

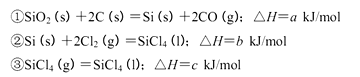
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体中直接排入空气时会引起酸雨的有__________(填化学式)。
(2)已知:2SO2(g)+ O2(g)=2SO3(g);△H=-196.6kJ/mol
O2(g)+2NO(g)=2NO2(g);△H=-113.0kJ/mol
①反应:NO2(g) +SO2(g)= SO3(g) +NO(g)的△H=_ kJ/mol。
②一定条件下,将NO2和SO2以体积比1:1置于恒温恒容的密闭容器中发生反应: NO2(g) +SO2(g) SO3(g) +NO(g),
SO3(g) +NO(g),
下列不能说明反应达到平衡状态的是_____(填字母)。
a.体系压强保持不变
b.混合气体的颜色保持不变
c.NO的物质的量保持不变
d.每生成1molSO3的同时消耗1molNO2
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)  CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。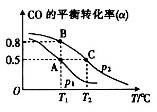
①上述合成甲醇的反应为______(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_____L。
(4)某研究小组设计了如图所示的甲醇燃料电池装置。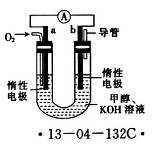
①该电池工作时,OH-向______(填“a”或“b”)极移动。
②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
研究CO2与CH4,反应使之转化为CO和H2,对减缓燃料危机、减小温室效应具有重要的意义。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=____________。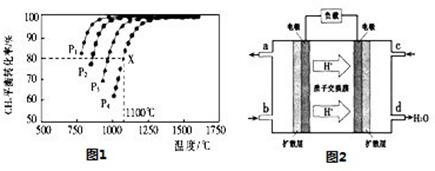
(2)在密闭容器中通人物质的量浓度均为0.1mol/L的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1:
①下列事实能说明该反应一定达到平衡的是 。
a.CO2的浓度不再发生变化
b.υ正(CH4)=2υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序为 。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡x点,则用CO表示该反应的速率为 ,该温度下,反应的平衡常数为 。
(3)用CO与H2可合成甲醇(CH3OH),以甲醇和氧气反应制成的燃料电池如图2所示,该电池工作程中O2应从 (填“c或一b”)口通人,电池负极反应式为 ,若用该电池电解精炼铜,每得到6. 4g铜,转移电子数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 甲 | 乙 | 丙 | ||
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 | ||
| 达到平衡的时间/min | | 5 | 8 | ||
| 平衡时N2的浓度/mol·L-1 | c1 | 1.5 | | ||
| NH3的体积分数 | ω1 | | ω3 | ||
| 混合气体密度/g·L-1 | ρ1 | ρ2 | |
 H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2 
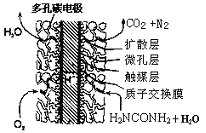
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
80℃时,2L密闭容器中充入0.40molN2O4,发生反应
N2O4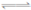 2NO2
2NO2 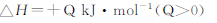 ,获得如下数据:
,获得如下数据: 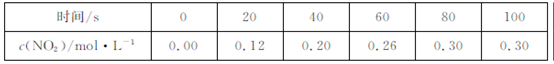 下列判断正确的是
下列判断正确的是
| A.升高温度该反应的平衡常数K减小 |
B.20~40s内,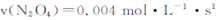 |
| C.反应达平衡时,吸收的热量为0.30QkJ |
| D.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com