
| A. | 1.0mol/L | B. | 2.0mol/L | C. | 3.0mol/L | D. | 4.0mol/L |
分析 根据稀释定律计算混合后溶液中c(SO42-),向混合溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余,说明溶液中溶质为FeSO4,根据硫酸根守恒c(FeSO4)=c(SO42-)来计算.
解答 解:把1.0mol/LCuSO4和1.0mol/L Fe2(SO4)3溶液等体积混合,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=$\frac{1}{2}$×1.0mol/L=0.5mol/L,c[Fe2(SO4)3]=$\frac{1}{2}$×1.0mol/L=0.5mol/L,混合后溶液中硫酸根来源于硫酸铜与硫酸铁电离,故 c(SO42-)=c(CuSO4)+3c[Fe2(SO4)3]=0.5mol/L+3×0.5mol/L=2mol/L,向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=2mol/L,故选B.
点评 本题考查物质的量浓度的有关计算,难度中等,注意对公式的理解与灵活运用,注意守恒思想的运用.


科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中加入适量的稀硫酸后,蒸干并灼烧 | |
| B. | 向NaAlO2溶液中通入过量的CO2后,过滤并灼烧 | |
| C. | 向AlCl3溶液中加入适量的NaAlO2溶液后,蒸干并灼烧 | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液后,过滤并灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
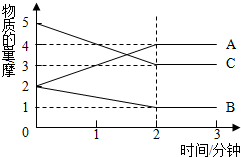 在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.
在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
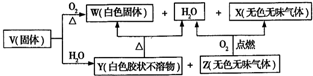
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物熔沸点较高、共价化合物熔沸点较低 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 确定某化合物为离子化合物,可以用融化时能否导电来判断 | |
| D. | 共价化合物中可能有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
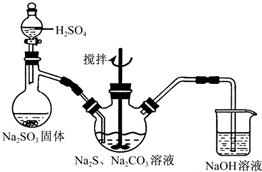 硫代硫酸钠(Na2S2O3)俗称海波,可用于纸浆漂白作脱氯剂等.实验室通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.
硫代硫酸钠(Na2S2O3)俗称海波,可用于纸浆漂白作脱氯剂等.实验室通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
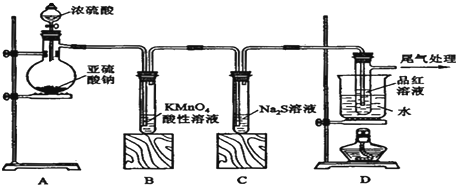
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com