
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入70 mL 4.0 mol/L盐酸中,充分反应后产生448 mL H2(标准状况),残留固体0.64 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.20 mol/L。则原混合物中单质铁的质量是
A.2.80g B.3.25g C.3.36g D.4.48g
科目:高中化学 来源:2014-2015学年山东省莱芜市高三1月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.任何化学反应都伴随着能量变化
B.放热反应的反应速率总是大于吸热反应的反应速率
C.离子化合物中一定含有离子键,可能含有共价键
D.强电解质与弱电解质的区别就是电解质在水溶液中是否完全电离
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高二上学期期末化学试卷(解析版) 题型:实验题
(8分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化
B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)下图,是某次滴定时的滴定管中的液面,其读数为 mL

(6)根据下列数据:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
请计算待测烧碱溶液的浓度(保留四位小数) mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高二上学期期末化学试卷(解析版) 题型:选择题
已知:HCN( aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1; HCl(aq)与NaOH(aq)反应的ΔH=-55. 6 kJ·mol-1。则HCN在水溶液中电离的ΔH等于
A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1
C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高二上学期期末化学试卷(解析版) 题型:选择题
在四个不同的容器中,在不同条件下进行合成氨的反应。根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A.v(H2)=0.1 mol·L-1·min-1
B.v(N2)=0.1 mol·L-1·min-1
C.v(N2)=0.2 mol·L-1·min-1
D.v(NH3)=0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏徐州市高一上学期期末考试化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的值。下列判断正确的是
A.0.5 mol/LFe2(SO4)3溶液中含有的SO42-数目为1.5NA
B.标准状况下,22.4L水中含有的分子数目为NA
C.常温常压下,4.4 g二氧化碳中含有的原子数为0.lNA
D.0.1 mol钠与足量水反应转移的电子数目为0.lNA
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏徐州市高一上学期期末考试化学试卷(解析版) 题型:选择题
现有三种液态混合物:①乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃);②汽油和水;③溴水。在实验室分离这三种混合物的正确方法依次为
A.蒸馏、分液、萃取 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二第一学期化学试卷(解析版) 题型:选择题
某温度下,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是
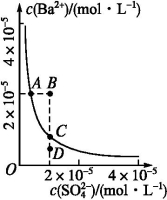
A.加入Na2SO4可以使溶液由A点变到B点
B.通过蒸发可以使溶液由D点变到C点
C.D点无BaSO4沉淀生成
D.A点对应的Ksp等于C点对应的Ksp
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省怀化市小学课改高二上学期期末化学试卷(解析版) 题型:填空题
(每空2分,共12分)
I、(1)已知1 g H2S气体完全燃烧,生成液态水和二氧化硫气体,放出17.24 kJ热量,请写出H2S气体燃烧热的热化学方程式:
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为 。
II、已知常温下在NaHSO3溶液中c(H2SO3 )<c(SO32 -) 且H2SO3 的电离平衡常数为: K1=1.5×10-2 K2=1.1×10-7 ;氨水的电离平衡常数为K=1.8×10-2 ;
(1)则等物质的量浓度的下列五种溶液:①NH3·H2O ②KHSO3 ③KHCO3 溶液中水的电离程度由大到小排列顺序为
(2)0.1 mol·L-1的NaHSO3溶液中C(H+) C(OH-)(“>”、“<”或“=”):
Ⅲ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)在25 ℃下,向浓度均为0.1 mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol/L。此时所得沉淀中________(填“含有”或“不含有”)Al(OH)3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com