
能正确表示下列反应的离子方程式的是( )
A.硫酸铝溶液中加入过量氨水
Al3++3OH-====Al(OH)3↓
B.碳酸钠溶液中加入澄清石灰水
Ca(OH)2+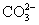 ====CaCO3↓+2OH-
====CaCO3↓+2OH-
C.冷的氢氧化钠溶液中通入氯气
Cl2+2OH-====ClO-+Cl-+H2O
D.稀硫酸中加入铁粉
2Fe+6H+====2Fe3++3H2↑
科目:高中化学 来源: 题型:
除去粗盐中的Ca2+、Mg2+、SO42﹣以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
称取粗盐
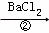
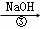
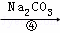
 滤液
滤液 
 粗盐
粗盐
(1)判断BaCl2已过量的方法是继续滴加氯化钡溶液不再出现沉淀.
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)l.
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是在..
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g.此混合气体中C和O两种原子的物质的量之比为()
A. 4:3 B. 3:4 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式2H++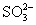 ====H2O+SO2↑的反应个数有( )
====H2O+SO2↑的反应个数有( )
A.4个 B.5个
C.8个 D.12个
查看答案和解析>>
科目:高中化学 来源: 题型:
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、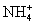 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、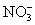 、
、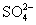 、
、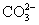 。已知:
。已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
回答下列问题:
(1)五种盐中,一定没有的阳离子是 ;
所含的阴离子相同的两种盐的化学式是 。
(2)D的化学式为 ,D溶液显碱性的原因是(用离子方程式表示) 。
(3)A和C的溶液反应的离子方程式是 。
E和氨水反应的离子方程式是 。
(4)若要检验B中所含的阳离子,正确的实验方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质熔化或汽化时所克服的微粒间的作用力属同种类型的是( )
A.石英和生石灰的熔化 B.晶体硅和晶体硫的熔化
C.钠和铁的熔化 D.碘和氯化铵的汽化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式正确的是( )
|
| A. | NH3•H2O═NH4﹣+OH﹣ | B. | NaHCO3═Na++H++CO32﹣ |
|
| C. | CH3COONa═CH3COO﹣+Na+ | D. | H2S⇌2H++S2﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特利原理来解释的是( )
|
| A. | 用排饱和食盐水的方法收集氯气 |
|
| B. | 合成氨工业选择高温 |
|
| C. | 增大压强,有利于SO2和O2反应生成SO3 |
|
| D. | 在Fe3++3SCN ﹣⇌Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com