
【题目】现使用酸碱中和滴定法测定市售白醋(主要成分是CH3COOH)的总酸量(g·100 mL-1)。已知CH3COOH + NaOH===CH3COONa + H2O 终点时所得溶液呈碱性。
Ⅰ.实验步骤:
(1)用移液管量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100mL__________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用_____取待测白醋溶液20.00 mL于锥形瓶中。
(3)滴加2滴_____________作指示剂。
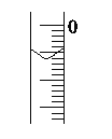
(4)读取盛装0.100 0 mol·L-1NaOH 溶液的碱式滴定管的初始读数。 如果液面位置如图所示,则此时的读数为________mL。
(5)滴定,当__________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)根据上述数据分析得c(市售白醋)=________mol·L-1。
(2)在本实验的滴定过程中,下列操作会使实验结果偏小的是_______(填写序号)。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
E. 滴定终点读数时俯视
【答案】容量瓶 酸式滴定管 酚酞 0.60ml 溶液由无色恰好变为浅红色,并在30s内不恢复到原来的颜色 0.75 DE
【解析】
依据中和滴定原理,确定所需仪器、药品、实验步骤,关注每步操作要领及意义。
Ⅰ.(1)用移液管量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液,故答案为:容量瓶;
(2)醋酸具有酸性能腐蚀橡胶管,所以应选用酸式滴定管量取白醋,故答案为:酸式滴定管;
(3)食醋与NaOH反应生成了强碱弱酸盐醋酸钠,由于醋酸钠溶液显示碱性,可用酚酞作指示剂,则用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞,故答案为:酚酞;
(4)视线与凹液面最低点相切的滴定管液面的读数0.60mL,故答案为:0.60;
(5)NaOH滴定食醋的终点为溶液由无色恰好变为红色,并在半分钟内不褪色,故答案为:溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅲ.(1)第1次滴定误差明显大,属异常值,应舍去,3次消耗NaOH溶液的体积为:15.00mL、15.05mL、14.95mL,则NaOH溶液的平均体积为15.00mL;设10.00 mL食用白醋为c mol·L-1,稀释后20mL白醋的浓度为c1 mol·L-1,则
CH3COOOH ~ NaOH
1mol 1mol
c1mol·L×0.02L 0.1000mol/L×0.015L
解得c1=0.075 mol·L-1,由稀释定律可得0.1L×0.075 mol·L=0.01L×cmol·L,解得c=0.75 mol·L-1,故答案为:0.75 mol·L-1;
(2)浓度误差分析,依据c(待测)= c(标准)V(标准)/ V(待测)进行分析。
A项、碱式滴定管在滴定时未用标准NaOH溶液润洗,会使得标准NaOH溶液浓度减小,造成V(标准)偏大,实验结果偏大,故A错误;
B项、碱式滴定管的尖嘴在滴定前有气泡,滴定后误气泡,造成V(标准)偏大,测定结果偏大,故B错误;
C项、锥形瓶中加入待测白醋溶液后,再加少量水,待测液的物质的量不变,对V(标准)无影响,故C错误;
D项、锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液的物质的量减小,造成V(标准)减小,测定结果偏小,故D正确;
E项、滴定终点读数时俯视度数,读出的最终标准液体积偏小,则消耗标准液体积偏小,测定结果偏低,故D正确;故答案为:DE。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH = –511kJmol-1

可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a管的作用是________。
(2)A中反应的离子方程式是________。
(3)D的作用是________。
(4)E中冷却水的作用是________。
(5)尾气处理时,可选用的装置是________(填序号)。

(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有________(填序号)。
A.蒸馏烧瓶 B.温度计 C.接收器 D.冷凝管 E.吸滤瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关石油炼制和煤的利用的说法正确的是( )
A. 煤的气化、液化和干馏是物理变化
B. 通过石油分馏得到的汽油是纯净物
C. 石油裂解是为了得到乙烯、丙烯等气态短链烃
D. 干馏的产物能提取出苯、甲苯等芳香烃,因为煤中含有苯和甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ___________ ,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)若去掉装置B,则导致测定结果 (填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度:

(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液态烃,0.1 mol该烃在足量的氧气中完全燃烧,生成0.6 mol CO2和0.3 molH2O;回答下列问题:
(1)A的电子式________,B的结构简式________。
(2)等质量的A、B完全燃烧时消耗O2的物质的量A_______B(填“>”、“<”或“=”)
(3)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_________________,反应类型:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、Q、R、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族族序数相等。它们的最高价氧化物的水化物依次为甲、乙、丙、丁。下列叙述不正确的是
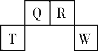
A. R的氢化物可以既有极性键又有非极性键
B. 常温下丁的浓溶液可用T单质所制的容器来盛装
C. 丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体
D. 甲、乙、丙、丁受热均易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造空气(氧气与氦气的混合气)可用于减轻某些病痛或供深水潜水员使用。标准状况下,5.6 L“人造空气”的质量是2.4 g,其中氧气与氦气的质量比是( )
A. 1∶1 B. 2∶1 C. 1∶4 D. 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
|
|
|
|
根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:ΔH>0,P2>P1 B. 反应Ⅱ:ΔH<0,T1<T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 D. 反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com