
| A. | 标准状况下,1 mol CCl4的体积约为22.4L | |
| B. | NaOH的摩尔质量是40g | |
| C. | 常温常压下,11.2L氧气与足量铜粉充分反应,转移的电子数为2NA | |
| D. | 46g NO2 和46g N2O4 含有的原子数均为3NA |
分析 A.四氯化碳标准状况为液体;
B.摩尔质量是以g/mol为单位,数值上等于其相对原子质量或相对分子质量;
C.标准状况下气体摩尔体积为22.4L/mol,使用条件是标准状况;
D.NO2和N2O4的最简式相同为NO2,只需计算46g NO2中所含原子数;
解答 解:A.标准状况下,四氯化碳为液体不是气体,1 mol CCl4的体积不是22.4L,故A错误;
B.NaOH的摩尔质量是40g/mol,故B错误;
C.标准状况下11.2L氧气物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,和铜反应电子转移=0.5mol×4×NA=2NA,常温常压下,11.2L氧气物质的量不是0.5mol,电子转移不是2NA,故C错误;
D.NO2和N2O4的最简式相同为NO2,计算46g NO2中所含原子数=$\frac{46g}{46g/mol}$×3×NA=3NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:选择题
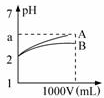 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )| A. | a=5时,A是强酸,B是弱酸 | |
| B. | 若A、B都是强酸,则5>a>2 | |
| C. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| D. | A、B两种酸溶液的物质的量浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质用途 | 解释 | |
| A | 食醋浸泡水壶中的水垢 | 水垢中CaCO3溶于醋酸,酸性H2CO3>CH3COOH |
| B | 炒菜时加一点酒和醋 | 有酯类物质生成,使菜味香可口 |
| C | NaClO溶液可用作洗手液 | NaClO具有杀菌、消毒作用 |
| D | Al2O3可用作医药中的胃酸中和剂 | Al2O3能与胃酸反应,使胃液酸度降低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L NH4Al(SO4)2溶液与0.01mol•L-1Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 用惰性电极电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 将标准状况下的11.2L氯气通入200mL2mol•L-1的FeBr2溶液中,离子反应方程式为:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+=Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
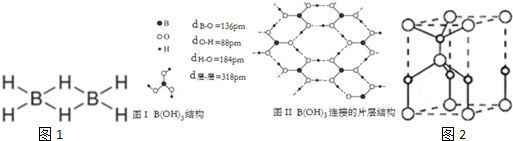
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
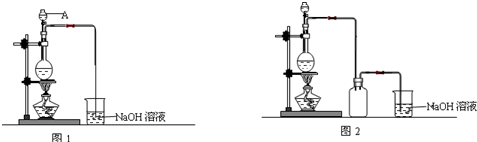
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
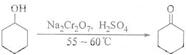
| 物质 | 沸点(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com