
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。
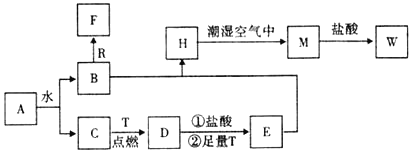
(1)物质A的化学式为_____,F化学式为____________;
(2)B和R在溶液中反应生成F的化学方程式为_____________________________;
(3)H在潮湿空气中变成M的化学方程式为_________________________________;
(4)A和水反应生成B和C的离子方程式为_________________________________;
(5)M投入盐酸中的离子方程式___________________________________________;
(6)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀的缘故。写出反应的离子方程式____________________________;
(7)小苏打可作胃药,请写出其中和胃酸时的离子方程式____________________。
【答案】Na2O2 H2 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Na2O2+2H2O=4Na++4OH-+O2↑ Fe(OH)3+3H+=Fe3++3H2O CO2+SiO32-+H2O=H2SiO3↓+CO32- HCO3-+H+= H2O+ CO2↑
【解析】
根据转化关系和反应条件,A为淡黄色固体且能与水反应,所以A为Na2O2,T为生活中使用最广泛常的金属单质,则T为Fe。R是地壳中含量最多的金属,则R为Al。D是具有磁性的黑色晶体,则D为Fe3O4,C、F是无色无味的气体,H是白色沉淀,过氧化钠与水反应生成B和C,铁与C反应生成Fe3O4,所以C为O2,B为NaOH,D与盐酸反应再与铁反应生成E为FeCl2,B与E反应生成H为Fe(OH)2,H与潮湿的空气反应生成M为Fe(OH)3,M与盐酸反应生成W为FeCl3,C、F是无色无味的气体,氢氧化钠与铝反应生成F为H2,据此答题。
(1)根据上面的分析可以知道,A为Na2O2,F为H2,
因此,本题正确答案是:Na2O2;H2;
(2) B为NaOH,R为Al,铝和氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
因此,本题正确答案是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3) H为Fe(OH)2,M为Fe(OH)3,Fe(OH)2在潮湿空气中变成Fe(OH)3的反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
因此,本题正确答案是: 4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4) A为Na2O2, 过氧化钠和水反应生成氢氧化钠和氧气,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
因此,本题正确答案是:2Na2O2+2H2O=4Na++4OH-+O2↑;
(5)M为Fe(OH)3,Fe(OH)3投入盐酸中的离子方程式Fe(OH)3+3H+=Fe3++3H2O,
因此,本题正确答案是:Fe(OH)3+3H+=Fe3++3H2O;
(6)“水玻璃”是硅酸钠的水溶液,由于硅酸酸性比碳酸弱,“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀为硅酸,离子方程式为CO2+SiO32-+H2O=H2SiO3↓+CO32-,
因此,本题正确答案是:CO2+SiO32-+H2O=H2SiO3↓+CO32-;
(7)小苏打为碳酸氢钠,和胃酸(盐酸)反应生成氯化钠、水和二氧化碳,反应的离子方程式为HCO3-+H+= H2O+ CO2↑,
因此,本题正确答案是:HCO3-+H+= H2O+ CO2↑。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】分类是化学研究中常用的方法.下列分类方法中,正确的是
A.依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等
B.NH4Cl组成中不含金属离子,不属于盐
C.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
D.依据组成元素的种类,将纯净物分为单质和化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
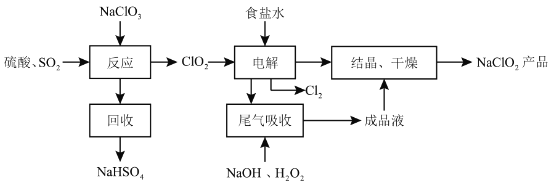
回答下列问题:
(1)NaClO2中![]() 的化合价为__________。
的化合价为__________。
(2)写出“反应”步骤中生成![]() 的化学方程式____________。
的化学方程式____________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去![]() 和
和![]() ,要加入的试剂分别为__________、__________。
,要加入的试剂分别为__________、__________。
(4)“尾气吸收”是吸收“电解”过程排出的少量![]() ,此吸收反应中,氧化剂与还原剂的物质的量之比为__________,该反应中氧化产物是____________。
,此吸收反应中,氧化剂与还原剂的物质的量之比为__________,该反应中氧化产物是____________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克![]() 的氧化能力。
的氧化能力。![]() 的有效氯含量为____________。(计算结果保留两位小数)。
的有效氯含量为____________。(计算结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①碘水;②银氨溶液;③NaOH溶液;④稀硫酸;⑤浓硫酸。在进行淀粉的水解实验(包括检验水解产物及水解是否完全)时,除淀粉外,还需使用上述试剂或其中一部分,判断使用的试剂及其先后顺序为( )
A.④①③② B.①④②③
C.⑤①③② D.①⑤②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.9克的镁铝合金,投入到500mL 2mol/L的盐酸中,金属完全溶解,再加入4mol/L的氢氧化钠溶液,若要生成沉淀最多,加入这种氢氧化钠溶液的体积是()
A.125mL B.200mL C.250mL D.560mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列物质①NaCl晶体 ②液态SO2 ③纯醋酸④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KNO3 ⑧NaOH溶液 ⑨氨水 请用以上物质回答下列问题(填序号)。
在上述状态下能导电的强电解质是__________________; 属于弱电解质的是________________;属于非电解质,但溶于水后的水溶液能导电的是_________________。
(2)化学平衡移动原理同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-。
NH4++OH-。
①向氨水中加入NH4Cl固体时,平衡____________移动,(填“向右”或“向左”),c(OH-)____(填“增大”或“减小”,下同),c(NH4+)______。
②向氨水中加入MgCl2固体时,平衡_____移动,(填“向右”或“向左”),c(OH-)____(填“增大”或“减小”,下同),c(NH4+)_________。
③升高温度,c(OH-)______(填“增大”或“减小”,下同),c(NH4+)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明某溶液只含有Fe2+而不含有Fe3+的实验方法是
A.先滴加氯水,再滴加KSCN溶液后显红
B.只需滴加KSCN溶液
C.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
D.加Na2O2固体后观察沉淀颜色的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如图所示。
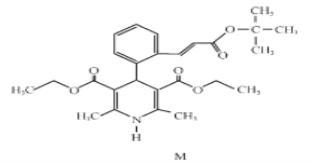
(1)下列关于M的说法正确的是______(填序号)。
a.属于芳香族化合物
b.遇FeCl3溶液显紫色
c.能使酸性高锰酸钾溶液褪色
d.1molM完全水解生成2mol醇
(2)肉桂酸是合成M的中间体,其一种合成路线如下:

已知: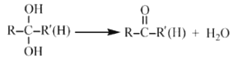
①烃A的名称为______。步骤I中B的产率往往偏低,其原因是__________。
②步骤III的反应类型是________。
③步骤Ⅳ反应的化学方程式为______________________________。
④肉桂酸的结构简式为__________________。
⑤C的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有_____种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com