
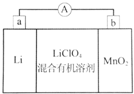
 锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池负极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 该电池电解液可用LiClO4水溶液代替 | |
| D. | 从废旧锂锰电池的正极材料中可回收金属Li、Mn |
分析 形成原电池反应时,Li为负极,被氧化,电极方程式为Li-e-=Li+,MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2,结合电极方程式以及元素化合价的变化解答该题.
解答 解:A、Li为负极,MnO2为正极,原电池工作时,外电路的电流方向从正极到负极,即从b极流向a极,故A错误;
B、Li为负极,被氧化,电极方程式为Li-e-=Li+,故B错误;
C、因负极材料为Li,可与水反应,则不能用水代替电池中的混合有机溶剂,故C错误;
D、从废旧锂锰电池的正极材料中可回收金属Li、Mn,故D正确;
故选D.
点评 本题侧重于电化学知识以及氧化还原反应的全面考查,题目难度适中,能很好地考查学生的分析能力、计算能力以及电化学知识的综合理解和运用,难度中等.


科目:高中化学 来源: 题型:解答题
| T/℃ | 0 | 10 | 20 | 30 | 40 |
| S(g/100g水) | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷、新戊烷、异戊烷互为同分异构体 | |
| B. | 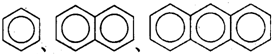 互为同系物 互为同系物 | |
| C. | 四氯乙烯分子中所有原子都处于同一平面 | |
| D. | 扁桃酸(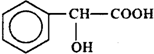 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| B. | 煤的气化和液化能提高煤的利用率、减少污染 | |
| C. | 利用Al2O3制作的坩埚,可用于熔融烧碱 | |
| D. | 煤的干馏、石油的分馏为物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 探究化学反应的限度:取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中即含I2又含I-的实验事实判断该反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu、Cu、稀硫酸 | B. | C、Pt、氯化钠溶液 | C. | Cu、Zn、酒精 | D. | Fe、Cu、FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com