
【题目】高温炼铜的反应之一为2CuFeS2+O2![]() Cu2S+2FeS+SO2。
Cu2S+2FeS+SO2。
(1)Cu+基态核外电子排布式为___________。
(2)Cu、Zn的第二电离能:I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(3)SO2分子中S原子的轨道杂化类型为________,分子的立体构型为________。
(4)[Cu(CH3CN)4]+是非常稳定的络合离子,配体中σ键和π键个数之比为________。
(5)Fe2+、Fe3+能与CN-络合,其结构如图所示。该离子可形成铁蓝钾盐,该钾盐的化学式为_________。
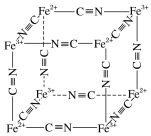
【答案】1s22s22p63s23p63d10(或[Ar]3d10) > sp2 V形 5∶2 KFeFe(CN)6或KFe[Fe(CN)6]
【解析】
(1)Cu是29号元素,其原子核外有29个电子,失去最外层4s能级上的一个电子生成Cu+,根据构造原理书写Cu+基态核外电子排布式;
(2)Zn的价电子排布式为3d104s2,Cu的价电子排布式为3d104s1,Cu失去一个电子内层达到饱和,再失去一个电子比较困难,Zn失去一个电子价层变为3d104s1,再失去一个电子比Cu+容易;
(3)SO2分子中S原子价层电子对个数![]() 且含有一个孤电子对,根据价层电子对互斥理论判断S原子的轨道杂化类型及分子的立体构型;
且含有一个孤电子对,根据价层电子对互斥理论判断S原子的轨道杂化类型及分子的立体构型;
(4)CH3CN中存在C-H单键、C-C单键和C≡N键,共价单键为σ键、共价三键中含有1个σ键和2个π键;
(5)该晶胞中Fe2+个数=Fe3+个数![]() ,CN-个数
,CN-个数![]() ,根据电荷守恒得K+个数
,根据电荷守恒得K+个数![]() ,则该晶胞中Fe2+、Fe3+、CN-、K+个数之比
,则该晶胞中Fe2+、Fe3+、CN-、K+个数之比![]() 。
。
(1)Cu是29号元素,其原子核外有29个电子,失去最外层4s能级上的一个电子生成Cu+,根据构造原理书写Cu+基态核外电子排布式为1s22s22p63s23p63d10(或[Ar]3d10),
故答案为:1s22s22p63s23p63d10(或[Ar]3d10);
(2)Zn的价电子排布式为3d104s2,Cu的价电子排布式为3d104s1,Cu失去一个电子内层达到饱和,再失去一个电子比较困难,Zn失去一个电子价层变为3d104s1,再失去一个电子比Cu+容易,所以Cu、Zn的第二电离能大小I2(Cu)>I2(Zn),
故答案为:>;
(3)SO2分子中S原子价层电子对个数![]() 且含有一个孤电子对,根据价层电子对互斥理论判断S原子的轨道杂化类型为sp2、分子的立体构型为V形;
且含有一个孤电子对,根据价层电子对互斥理论判断S原子的轨道杂化类型为sp2、分子的立体构型为V形;
故答案为:sp2;V形;
(4)CH3CN中存在CH单键、CC单键和C≡N键,共价单键为σ键、共价三键中含有1个σ键和2个π键,所以配体中σ键和π键个数之比为5:2,
故答案为:5:2;
(5) 该晶胞中Fe2+个数=Fe3+个数![]() ,CN-个数
,CN-个数![]() ,根据电荷守恒得K+个数
,根据电荷守恒得K+个数![]() ,则该晶胞中Fe2+、Fe3+、CN-、K+个数之比
,则该晶胞中Fe2+、Fe3+、CN-、K+个数之比![]() ,所以其化学式为KFeFe(CN)6或KFe[Fe(CN)6],
,所以其化学式为KFeFe(CN)6或KFe[Fe(CN)6],
故答案为:KFeFe(CN)6或KFe[Fe(CN)6]。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.乙酸钠溶液和盐酸混合:CH3COO-+H3O+![]() CH3COOH+H2O
CH3COOH+H2O
B.醋酸钠的水解反应:CH3COO-+ H3O+![]() CH3COOH+H2O
CH3COOH+H2O
C.用石墨电极电解饱和MgCl2溶液:2Cl+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.向苯酚钠溶液中通入少量CO2:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
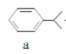
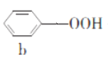
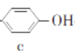
【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下,下列有关说法正确的是
![]()
![]()
 +
+![]()
A.a、b、c均属于芳香烃B.a、d中所有碳原子均处于同一平面上
C.A有9种属于芳香族的同分异构体D.c、d均能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油酸甘油酯(相对分子质量884)是一种典型的脂肪,在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)。已知要消耗1kg该化合物,常人需快走约200公里(每快走1公里按平均耗能190 kJ计)。则油酸甘油酯的燃烧热△H约为( )
A.3.8×104kJ·mol-1B.-3.8×104kJ·mol-1
C.3.4×104kJ·mol-1D.-3.4×104kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途。相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________,基态S原子电子占据最高能级的电子云轮廓图为____________形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是____________。
(3)图(a)为S2的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____________。
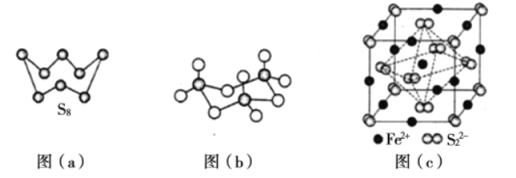
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为____________形,其中共价键的类型有____________种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为____________。
(5) FeS2晶体的晶胞如图(c)所示,晶胞边长为a nm, FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________g·cm-3;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为____________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往二元弱酸的钠盐Na2A溶液中通入HCl,溶液中-lg![]() 和-lgc(A2-)的关系如图所示。下列说法正确的是( )
和-lgc(A2-)的关系如图所示。下列说法正确的是( )
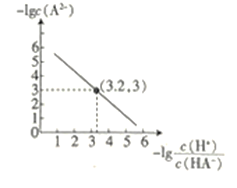
A.K(HA-)的数量级为10-7
B.通入HCl的过程中,水电离出的c(H+)不断增大
C.在Na2A溶液中:c(OH-)= c(H2A)+ c(HA-)+ c(H+)
D.当通入的HCl的物质的量与Na2A的物质的量相等时c(Na+)+ c(H+)= c(HA-)+2 c(A2-)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在恒容容器中进行,达到平衡状态的标志是( )
在恒容容器中进行,达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 、
、![]() 、
、![]() 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥B.②③⑤C.①③④D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com