
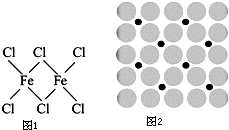
 铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题:
铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题: ,并可判断碳原子的杂化方式;
,并可判断碳原子的杂化方式;| 质量 |
| 体积 |
 ,并可判断碳原子的杂化方式为sp杂化;
,并可判断碳原子的杂化方式为sp杂化; ,故答案为:分子晶体;
,故答案为:分子晶体;  ;
;| 1 |
| 2 |
| 74% |
| 68% |
| 1 |
| 8 |
| 质量 |
| 体积 |
| ||
| a3 |
| 3 |
| ||
| 3 |
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
| 选项 | 叙述I | 叙述Ⅱ |
| A | 干燥的Cl2通入品红溶液中,品红褪色 | 干燥的Cl2具有漂白性 |
| B | NH4Cl受热易分解 | 用加热法除去 NaCl中的NH4Cl |
| C | Na2O2使酚酞溶液变红 | Na2O2使品红溶液褪色 |
| D | CaCO3难溶于水 | CO2通入CaCl2溶液中产生白色沉淀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠保存在煤油中 |
| B、新制的氯水保存在无色广口瓶中 |
| C、NaOH溶液保存在带胶塞的玻璃试剂瓶中 |
| D、存放FeSO4溶液时加入少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图是维生素A的分子结构:
(1)如图是维生素A的分子结构:查看答案和解析>>
科目:高中化学 来源: 题型:
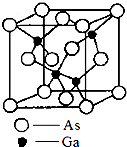 砷化镓(gallium arsenide)的化学式为GaAs,是黑灰色固体,熔点为1238℃.它是一种重要的半导体材料,用来制作微波集成电路[例如单晶微波集成电路(MMIC)]、红外线发光二极管、半导体激光器和太阳能电池等元件.
砷化镓(gallium arsenide)的化学式为GaAs,是黑灰色固体,熔点为1238℃.它是一种重要的半导体材料,用来制作微波集成电路[例如单晶微波集成电路(MMIC)]、红外线发光二极管、半导体激光器和太阳能电池等元件.查看答案和解析>>
科目:高中化学 来源: 题型:
 有机物M的结构简式如图所示.
有机物M的结构简式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A、反应的化学方程式为4X?Y |
| B、当t1=2时,用X表示该反应在2min内的平均反应速率为0.25mol/(L?min) |
| C、t2时,正反应速率等于逆反应速率 |
| D、t3时,Y浓度不再变化,反应达到平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com