
| A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| C. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ | |
| D. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
分析 A.铝离子与强碱性溶液中的氢氧根离子反应;
B.水电离出来的c(H+)=10-13mol/L的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子能够与氢离子和氢氧根离子反应;
C.碳酸根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
D.pH=1的溶液中含有大量氢离子,四种离子之间不反应,都不与氢离子反应.
解答 解:A.Al3+与强碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.水电离出来的c(H+)=10-13mol/L的溶液为酸性或碱性溶液,HCO3-能够与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.CO32-、Al3+之间是双水解反应,在溶液中不能大量共存,故C错误;
D.室温下pH=1的溶液为酸性溶液,Na+、Fe3+、NO3-、SO42-离子之间不反应,都不与酸性溶液反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:解答题
| 温度 试剂 | T1/℃ | T2/℃ | T3/℃ |
| NaCO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
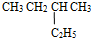 和
和 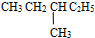 ⑤
⑤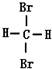 和
和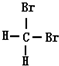
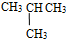 ⑦C2H5OH和C4H9OH
⑦C2H5OH和C4H9OH查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| C. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2?2SO3 △H=-196.6kJ/mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═2H2O(l)△H=-285.8kJ/mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6kJ•mol-1 | |
| D. | C(s)+O2(g)═CO2(g)△H=+395.9kJ/mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 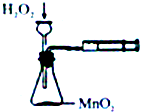 定量测定化学反应速率 | B. | 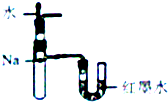 验证Na和水反应的热效应 | ||
| C. | 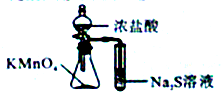 比较KMnO4、cl2、S的氧化性 | D. | 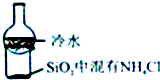 加热烧杯,分离SiO2和NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
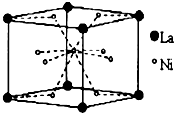 储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.
储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH,LiOH,HNO3,H3PO4 | B. | Mg(OH)2,Al(OH)3,HBrO4,HClO4 | ||
| C. | Mg(OH)2,Ca(OH)2,H3PO4,H2SO4 | D. | NaOH,Mg(OH)2,H3PO4,HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com