
 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图1所示:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图1所示:

科目:高中化学 来源: 题型:
 在实验室进行工业合成氨的模拟实验:
在实验室进行工业合成氨的模拟实验:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为碘晶体晶胞结构.有关说法中正确的是
如图为碘晶体晶胞结构.有关说法中正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
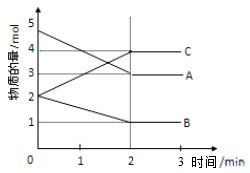 某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:
某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973k | 1173k | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | k1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | k2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | k3 | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液中:c(H+)+c(H2CO3)═(CO32-)+c(OH-) |
| B、25℃时,0.2mol?L-1盐酸与等体积0.05mol?L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| C、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| D、25℃时,若0.3mol?L-1 HY溶液与0.3mol?L-1 NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=c(H+)=1×10-9mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com