
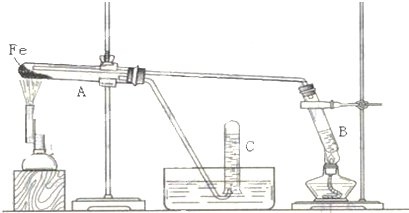
分析 (1)金属铁和水蒸气在高温下发生反应,生成的是四氧化三铁和氢气,氢气在点燃之前要验纯;
(2)金属铁和水蒸气在高温下发生反应,生成的是四氧化三铁、氢气,据此书写方程式即可.
解答 解:(1)金属铁和水蒸气在高温下发生反应,生成的是四氧化三铁和氢气,实验进行时试管B的作用是产生水蒸气,在试管C中收集得到的是氢气,氢气在点燃之前要验纯,故答案为:产生水蒸气;氢气;检验氢气的纯度;
(2)金属铁和水蒸气在高温下发生反应,生成的是四氧化三铁、氢气,四氧化三铁是黑色固体物质,反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题考查学生金属铁和水蒸气在高温下的反应知识,属于基本知识的考查,注意实验原理的分析是关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
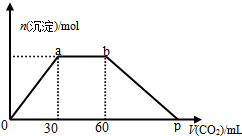
| A. | 原混合物中n[Ba(OH)2]:n[NaOH]=1:2 | |
| B. | p点横坐标为120 | |
| C. | p点中溶质为Ba(HCO3)2 | |
| D. | ab段反应可分两段,离子方程式依次为:CO2+2OH-=H2O+CO32- CO2+H2O+CO32-=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 微粒 | A | B | C | D |
| 原子核数 | 双核 | 多核 | 多核 | 多核 |
| 所带单位电荷 | -1 | 0 | +1 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、C、O、Na | B. | H、K、O、S | C. | H、O、S | D. | H、N、O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).| 实验序号 | 实验目的 | 初始pH | 废水样品体积mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考废水的初始pH对 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氯反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.
,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com