
���� ��1��H2SO3��H2CO3�����ڶ�Ԫ�ᣬҪ��ͨ���Ƚ϶��ߵ�pH����֤���ߵ�����ǿ��������ʹ���ߵ�Ũ����ͬ������SO2��CO2��������ˮ��ı�����Һ��Ũ����Ȼ����ȣ���Ϊ���ߵ��ܽ�Ȳ�ͬ�������Ը�ʵ����Ʋ���ȷ��
��2��Ҫ��������ǿ�������Բ��ö��ַ�������������ˮ��ԭ������Խ����Ӧ��ǿ���ξ�Խ��ˮ�⣩��Ҳ�������ý�ǿ������ȡ�������������飻
��3��������SO2����ͨ��Na2CO3��Һ�з�Ӧ����̼�����ƺ��������ƣ�
��4��Na2CO3��ǿ�������Σ�CO32-ˮ�����Һ�ʼ��ԣ�ƽ�ⳣ��K=$\frac{c��O{H}^{-}��c��HC{{O}_{3}}^{-}��}{c��C{{O}_{3}}^{2-}��}$��
��� �⣺��1��H2SO3��H2CO3�����ڶ�Ԫ�ᣬҪ��ͨ���Ƚ϶��ߵ�pH����֤���ߵ�����ǿ��������ʹ���ߵ�Ũ����ͬ������SO2��CO2��������ˮ��ı�����Һ��Ũ����Ȼ����ȣ���Ϊ���ߵ��ܽ�Ȳ�ͬ�������Ը�ʵ����Ʋ���ȷ��
��2��Ҫ��������ǿ�������Բ��ö��ַ�������������ˮ��ԭ������Խ����Ӧ��ǿ���ξ�Խ��ˮ�⣩��Ҳ�������ý�ǿ������ȡ��������������ʴ�Ϊ�����ڱȽ�pH������������ʵ���Ũ�Ȳ���ȣ�������ͬ���ʵ���Ũ�ȵ�NaHSO3��NaHCO3��Һ������ȼƣ���pH��ֽ��������Һ��pH��ǰ�ߵ�pHС�ں��ߣ�֤��H2SO3����ǿ��H2CO3��
�ʴ�Ϊ��������ͬ���ʵ���Ũ�ȵ�NaHSO3��NaHCO3��Һ������ȼƣ���pH��ֽ��������Һ��pH��ǰ�ߵ�pHС�ں��ߣ�֤��H2SO3����ǿ��H2CO3��
��3��������SO2����ͨ��Na2CO3��Һ�з�Ӧ����̼�����ƺ��������ƣ���Ӧ�Ļ�ѧ����ʽΪ��SO2+H2O+2Na2CO3=2NaHCO3+Na2SO3��
�ʴ�Ϊ��SO2+H2O+2Na2CO3=2NaHCO3+Na2SO3��
��4��Na2CO3��ǿ�������Σ�CO32-ˮ�����Һ�ʼ��ԣ�ˮ�����ӷ���ʽΪ��CO32-+H2O?HCO3-+OH-��
ƽ�ⳣ��K=$\frac{c��O{H}^{-}��c��HC{{O}_{3}}^{-}��}{c��C{{O}_{3}}^{2-}��}$=$\frac{c��O{H}^{-}��c��HC{{O}_{3}}^{-}��}{c��C{{O}_{3}}^{2-}��}$��$\frac{c��{H}^{+}��}{c��{H}^{+}��}$=$\frac{Kw}{K{a}_{2}}$=$\frac{1{0}^{-14}}{4.7��1{0}^{-11}}$=2.13��10-4��
�ʴ�Ϊ��2.13��10-4��
���� ���⿼����������ʵ���ƽ��Ӱ�����ء�����ˮ�⡢ƽ�ⳣ������ȣ����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Һ��������̼��īˮ���ɷ������������ | |
| B�� | ������ˮʱ�����˻�ѧ�������仯������ɱ�������������� | |
| C�� | ���ͷ����Ҫ�ɷ�������غ����ʣ��ֱ����ڵ���ʺͷǵ���� | |
| D�� | ��������Һ�м���CuSO4��Һ���г��������������ʿ����ڵ����ʵķ������ᴿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu��Mg | B�� | Mg��Al | C�� | Al �� Si | D�� | SiO2��Zn |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
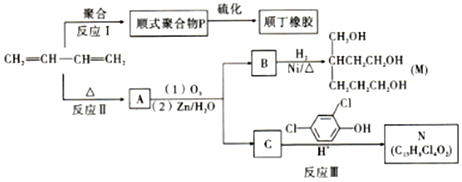
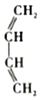 +
+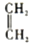 $\stackrel{��}{��}$
$\stackrel{��}{��}$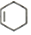
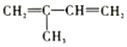 ��������2-��-1��3-����ϩ��
��������2-��-1��3-����ϩ�� b��
b�� c��
c��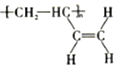
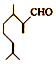
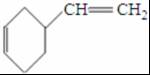 ����ӦIII�Ļ�ѧ����ʽ��
����ӦIII�Ļ�ѧ����ʽ��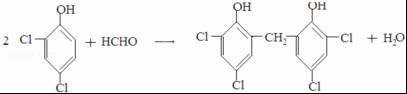 ��1molB��ȫת����M������H2��������6g��
��1molB��ȫת����M������H2��������6g��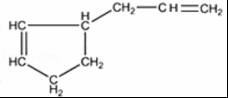 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��̭�ͽ�ֹ�Ʊ공������Ⱦ�ŷų�������·��ʻ���ɼ����������� | |
| B�� | ú�ĸ���Һ����������Ϊ��ѧ�仯 | |
| C�� | �������Ҵ����������Ƶ�������������ɱ�����÷��ز��� | |
| D�� | ��������������Դ���滯ʯȼ�ϣ������й������绷���յ�����--��������ɫ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
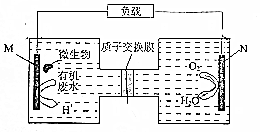 ��������ָ������������½���ѧ��ת��Ϊ���ܵ�װ�ã���ͼ������һ�����ォ�л���ˮ�е�����[CO��NH2��3]ת��Ϊ�Ի��������ʵ�װ�ã���������������ǣ�������
��������ָ������������½���ѧ��ת��Ϊ���ܵ�װ�ã���ͼ������һ�����ォ�л���ˮ�е�����[CO��NH2��3]ת��Ϊ�Ի��������ʵ�װ�ã���������������ǣ�������| A�� | M�缫��CO2��N2���� | B�� | H+�����ӽ���Ĥ���������ƶ� | ||
| C�� | ����ٽ��˷�Ӧ�е��ӵ�ת�� | D�� | N�缫��ӦʽΪ��O2+2H2O+4e-�T4OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����һ����Ҫ�����ϣ�������������������ɶ�������ױ���
����һ����Ҫ�����ϣ�������������������ɶ�������ױ��� �� �����й���Ҷȩ���������ױ���������ȷ���ǣ�������
�� �����й���Ҷȩ���������ױ���������ȷ���ǣ�������| A�� | ����Ϊͬ���칹�� | |
| B�� | ���߾�������ˮ�����ӳɷ�Ӧ | |
| C�� | ��Ҷȩ��һ��ͬ���칹������Ƿ��㴼 | |
| D�� | ��������ױ��ķ���ʽΪC10H14 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com