
(15分)某研究小组探究SO2和Fe(NO3)3溶液的反应。

已知:1.0 mol/L的Fe(NO3)3溶液的pH=l
请回答:
(1)装置A中反应的化学方程式是____________。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是___________。
(3)装置B中产生了白色沉淀,其成分是____________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因:
观点1.____________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①按观点2,装置B中反应的离子方程式是___________,为证明该观点应进一步检验生成的新物质,其实验操作及现象是__________。
②按观点3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号)____________。
a.0.1 mol/L稀硝酸
b.1.5 mol/L Fe(NO3)2溶液
c.6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
(1)Na2SO3+H2SO4(浓) = Na2SO4+ SO2↑+H2O(2分)
(2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹(2分)
(3)BaSO4 (1分) 还原性(1分)
(4)观点1:SO2和Fe3+、酸性条件下NO3-都反应(2分)
①SO2+ 2Fe3++Ba2++2H2O== BaSO4↓+2Fe2++4H+(2分)
取少量B溶液于试管中,加入少量的酸性KMnO4溶液,紫色褪去则溶液中有Fe2+,然后用湿润的淀粉KI试纸靠近B导管末端,若不变蓝,说明NO3-没反应则证明观点2合理(3分)
②c(2分)
【解析】(1)浓硫酸和亚硫酸钠反应生成SO2,方程式为Na2SO3+H2SO4(浓) = Na2SO4+ SO2↑+H2O。
(2)要排除空气对实验的干扰,则就需要排尽装置中的空气。可利用氮气来排尽装置中的空气,即打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹。
(3)B中溶液显酸性,因此不可能是亚硫酸钡沉淀,只能是硫酸钡沉淀。这说明SO2被氧化生成了硫酸产生的,因此SO2具有还原性。
(4)根据观点2、3可知,观点1应是SO2和Fe3+、酸性条件下NO3-都反应。
①如果是②,则铁离子的还原产物是亚铁离子,所以方程式为O2+ 2Fe3++Ba2++2H2O==
BaSO4↓+2Fe2++4H+。要检验亚铁离子,可利用其还原性进行检验,即取少量B溶液于试管中,加入少量的酸性KMnO4溶液,紫色褪去则溶液中有Fe2+。如果NO3-氧化了SO2,则其还原产物是NO,NO具有氧化性,可以利用湿润的淀粉KI试纸,即用湿润的淀粉KI试纸靠近B导管末端,若不变蓝,说明NO3-没反应则证明观点2合理。
②为排除铁离子的干扰,可以选择不含铁离子的硝酸盐即可,所以答案选C。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2011-2012年黑龙江大庆铁人中学高一下学期第一次阶段检测化学试卷(带解析) 题型:实验题
(8分)某研究小组探究SO2和Fe(NO3)3溶液的反应。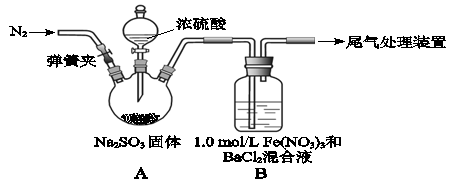
已知: 1.0 mol/L的Fe(NO3)3溶液中c(H+)=0.01mol/L
请回答:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
(4)分析B中产生上述白色沉淀的原因可能是:
观点1: ;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①如果观点2正确,装置B中反应的离子方程式是
②如果想验证观点3,只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号) 。
a.0.1 mol/L 稀硝酸
b.1.5 mol/L Fe(NO3)2溶液
c.6.0 mol/L NaNO3和0.02 mol/L盐酸等体积混合的溶液
查看答案和解析>>
科目:高中化学 来源:2013届福建省三明一中、二中高三上学期期末联考化学试卷(带解析) 题型:实验题
某研究小组探究SO2和Fe(NO3)3溶液的反应。
已知: 1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
(4)分析B中产生白色沉淀的原因:
观点1: _____________________________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①若观点2正确,装置B中反应的离子方程式是 。
②只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,即可证明观点3是否正确,应选择的试剂是(填序号) 。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1 Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol/L盐酸等体积混合的溶液
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省、二中高三上学期期末联考化学试卷(解析版) 题型:实验题
某研究小组探究SO2和Fe(NO3)3溶液的反应。

已知: 1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
(4)分析B中产生白色沉淀的原因:
观点1: _____________________________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①若观点2正确,装置B中反应的离子方程式是 。
②只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,即可证明观点3是否正确,应选择的试剂是(填序号) 。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1 Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol/L盐酸等体积混合的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com