
| A. | 小苏打溶液中加入NaOH溶液:H ++OH-=H2O | |
| B. | 氧化铁与稀盐酸反应:FeO+2H+=Fe2++H2O | |
| C. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓ | |
| D. | 氯化钡与纯碱溶液反应:Ba2++CO32-=BaCO3↓ |
分析 A.小苏打为碳酸氢钠,碳酸氢根离子不能拆开;
B.氧化铁为三氧化二铁,不是氧化亚铁;
C.漏掉了钡离子与硫酸根离子生成硫酸钡的反应;
D.氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠.
解答 解:A.小苏打溶液中加入NaOH溶液,二者反应生成碳酸钠和水,正确的离子方程式为:HCO3-+OH-=H2O+CO32-,故A错误;
B.氧化铁与稀盐酸反应生成氯化铁和水,正确的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故B错误;
C.硫酸铜与氢氧化钡溶液反应生成硫酸钡、氢氧化铜沉淀,正确的离子方程式为:SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓,故C错误;
D.氯化钡与纯碱溶液反应的离子方程式为:Ba2++CO32-=BaCO3↓,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4=H2++SO42- | B. | Ba(OH)2=Ba2++OH - | ||
| C. | NaNO3=Na ++NO3- | D. | CuSO4=Cu+2+SO4-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
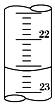 中和滴定的相关问题
中和滴定的相关问题| 滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C7H8O且含苯环的有机化合物有4种 | |
| B. | 乙醇能使酸性高锰酸钾溶液褪色 | |
| C. | 由溴丙烷水解制丙醇和由丙烯与水反应制丙醇反应类型相同 | |
| D. | 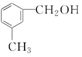 遇FeCl3溶液可显紫色 遇FeCl3溶液可显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Y的价电子轨道表示式为
;Y的价电子轨道表示式为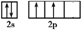 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
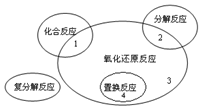 (1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D
(1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100 nm之间 | |
| B. | 溶液呈电中性,胶体带有电荷 | |
| C. | 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 | |
| D. | 制备氢氧化铁胶体时,可以将饱和FeCl3溶液滴入沸水,然后长时间煮沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液的物质的量浓度为1 mol.L-1 | |
| B. | 所得溶液中含有NA个HCl分子 | |
| C. | 36.5 g HCl气体占有的体积为22.4 L | |
| D. | 所得溶液的质量分数:w=$\frac{36.5c}{1000ρ}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com