
(15分)(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 = 6CaSiO3+P4O10 10C+P4O10 = P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有 。
(3)白磷有剧毒,不慎沾到皮肤上,可用CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成磷化亚铜,与冷溶液则析出铜,反应方程式分别(均未配平)为:
①P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4
②P4+CuSO4+H2O→Cu+H3PO4+H2SO4
反应①中,氧化剂为 ,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为 。
(Ⅱ)离子交换膜是一类具有离子交换功能的高分子材料。一容器被离子交换膜分成左右两部分,如图所示。

若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象: ;若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42-通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为 。
(Ⅲ)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用。通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b。(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃。)
(1)若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,
化学反应方程式为 _________。
(2)若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有 _________。
(Ⅰ)(1)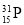 (1分)
(1分)
(2)SiO2 P4O10 (2分,答对1个给1分)
(3)CuSO4 和P4 (2分,少答或错答不得分) 1:1(2分)
(Ⅱ)溶液由浅绿色变红色(2分) 2:3(2分)
(Ⅲ)(1)SiCl4+6NaOH =Na2SiO3+4NaCl+3H2O(2分)
(2)Cl-、OH-、AlO2-(2分)
【解析】
试题分析:(Ⅰ)(1)磷为15号元素,磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为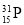 。(2)根据物质分类的原则判断,上述反应中的各种物质,属于酸性氧化物的有SiO2 P4O10。(3)反应①中,磷元素的化合价由0价部分降为—3价,铜元素的化合价由+2价降为+1价,得电子,故氧化剂为CuSO4 和P4,若被氧化的白磷都是1mol,则反应中转移电子是20mol,所以根据电子的得失守恒可知,反应①中需要硫酸铜是20/6×3=10mol。而在反应②需要硫酸铜是20÷2=10mol,所以消耗的CuSO4的物质的量之比为1︰1。(Ⅱ)若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),Fe2+透过阳离子交换膜进入左边,发生反应:2Fe2+ + H2O2 + 2H+====2Fe3+ + 2H2O,生成的Fe3+透过离子交换膜进入右边,与KSCN发生络合反应,一段时间后右边可观察到的现象:溶液由浅绿色变红色;若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,左边发生的反应为:Al3+ + 3OH-====Al(OH)3↓,右边发生的反应为Ba2+ + SO42-====BaSO4↓,根据电荷守恒当有2mol SO42-通过交换膜进入右边时有4molOH—进入右边,左边生成沉淀的物质的量为4/3mol,右边生成沉淀的物质的量为2mol,则左右两室沉淀的物质的量之比为2:3。(Ⅲ)根据题意知,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,通入一定量的N2排除装置内的空气后,在1500℃下与Cl2充分反应得到纯化石墨与SiCl4、AlCl3、Fe Cl3和Mg Cl2等气体混合物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,降温至80℃,分别得到液态物质SiCl4和气态混合物AlCl3、Fe Cl3和Mg Cl2。(1)a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性为硅酸钠溶液,则a为液态物质SiCl4,化学反应方程式为SiCl4+6NaOH =Na2SiO3+4NaCl+3H2O;(2)b为气态混合物AlCl3、Fe Cl3和Mg Cl2,与过量的NaOH溶液充分反应后,过滤,得固体物质氢氧化镁、氢氧化铁和氢氧化钠、氯化钠、偏铝酸钠的混合液,所得滤液中阴离子有Cl-、OH-、AlO2-。
。(2)根据物质分类的原则判断,上述反应中的各种物质,属于酸性氧化物的有SiO2 P4O10。(3)反应①中,磷元素的化合价由0价部分降为—3价,铜元素的化合价由+2价降为+1价,得电子,故氧化剂为CuSO4 和P4,若被氧化的白磷都是1mol,则反应中转移电子是20mol,所以根据电子的得失守恒可知,反应①中需要硫酸铜是20/6×3=10mol。而在反应②需要硫酸铜是20÷2=10mol,所以消耗的CuSO4的物质的量之比为1︰1。(Ⅱ)若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),Fe2+透过阳离子交换膜进入左边,发生反应:2Fe2+ + H2O2 + 2H+====2Fe3+ + 2H2O,生成的Fe3+透过离子交换膜进入右边,与KSCN发生络合反应,一段时间后右边可观察到的现象:溶液由浅绿色变红色;若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,左边发生的反应为:Al3+ + 3OH-====Al(OH)3↓,右边发生的反应为Ba2+ + SO42-====BaSO4↓,根据电荷守恒当有2mol SO42-通过交换膜进入右边时有4molOH—进入右边,左边生成沉淀的物质的量为4/3mol,右边生成沉淀的物质的量为2mol,则左右两室沉淀的物质的量之比为2:3。(Ⅲ)根据题意知,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,通入一定量的N2排除装置内的空气后,在1500℃下与Cl2充分反应得到纯化石墨与SiCl4、AlCl3、Fe Cl3和Mg Cl2等气体混合物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,降温至80℃,分别得到液态物质SiCl4和气态混合物AlCl3、Fe Cl3和Mg Cl2。(1)a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性为硅酸钠溶液,则a为液态物质SiCl4,化学反应方程式为SiCl4+6NaOH =Na2SiO3+4NaCl+3H2O;(2)b为气态混合物AlCl3、Fe Cl3和Mg Cl2,与过量的NaOH溶液充分反应后,过滤,得固体物质氢氧化镁、氢氧化铁和氢氧化钠、氯化钠、偏铝酸钠的混合液,所得滤液中阴离子有Cl-、OH-、AlO2-。
考点:考查氧化还原反应和离子反应。
考点分析: 考点1:氧化还原反应 考点2:氮族元素 试题属性

 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:选择题
下列图示与对应叙述相符合的是
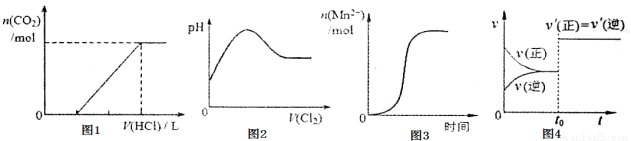
A.图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸体积的关系
B.图2表示Cl2通入SO2水溶液中,溶液pH的变化
C.图3表示10mL0.01mol·L-1KMnO4酸性溶液与过量0.1mol·L-1H2C2O4溶液混合时,Mn2+浓度随时间的变化情况(已知Mn2+对该反应有催化作用)
D.图4表示密闭容器中的某反应达到平衡,在t0时改变某一条件反应速率(v)所发生的变化,则改变在条件可能是增大压强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三下学期一模考试理综化学试卷(解析版) 题型:填空题
选做(12分)【化学——化学与技术】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可以提高煤的利用率。煤的气化技术的主要产物是 。煤的液化技术又分为直接液化和间接氧化。将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为 。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放。
①在燃烧前,可以采用微生物脱硫技术。原理如下:
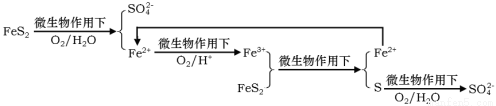
上述过程中Fe2+的作用为 。写出Fe2+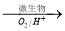 Fe3+的离子方程式 。
Fe3+的离子方程式 。
②煤在燃烧时,进行脱硫处理,常采用 燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为 (填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术。湿法脱硫、脱硝技术中将烟气通入 设备,用石灰水淋洗。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省盟校高三第一次十校联考理综化学试卷(解析版) 题型:选择题
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述不正确的是
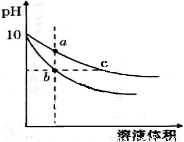
A.b、c两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中C(H+) + C(CH3COOH)= C(OH-)
D.用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省红色六校高三第二次联考理综化学试卷(解析版) 题型:推断题
【化学选修5有机化学基础】(15分)物质A有如下转化:
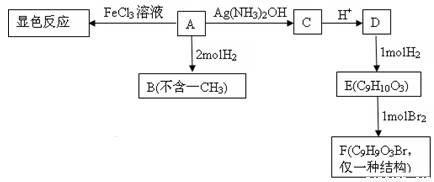
(1)A的分子式为 ,F的结构简式为 .。
(2)A→C的化学方程式为_______________________________,反应类型为__________。
(3)B的同分异构体中能与浓溴水反应,满足条件:①1 mol物质最多能消耗3 mol Br2②苯环上只有两个取代基③分子中只出现一个—CH3的结构有____________种。
(4)已知在一定条件下R1CH===CHR2―→R1CHO+R2CHO,A在一定条件下氧化生成X、Y(A中酚羟基已被保护),X的分子式为C7H6O2,它是芳香族化合物,Y可进一步氧化得到一种还原性的二元羧酸。
①写出两类含有醛基X的同分异构体____________,____________。
②Y与乙二醇发生酯化反应形成高分子化合物的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省红色六校高三第二次联考理综化学试卷(解析版) 题型:选择题
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中,一定能大量共存的是
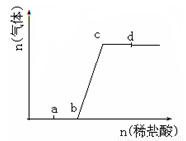
A.a点对应的溶液中:Na+、OH-、SO42-、NO3--
B.b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高三第三次四校联考理综化学试卷(解析版) 题型:实验题
(15分)实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应如下:
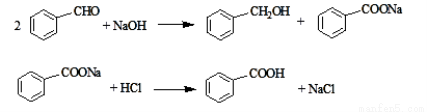
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)。
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高于250℃
④苯甲醇沸点为205.3℃
实验步骤如下:
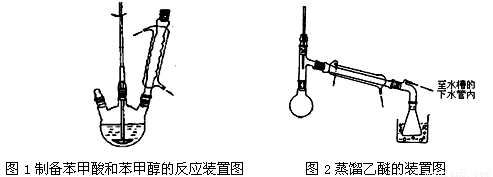
①向图l所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。然后用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10 mL 10%碳酸钠溶液洗涤,10 mL水洗涤,然后分液,将水层弃去,所得醚层进行实验步骤③。
③将分出的醚层,倒入干燥的锥形瓶中,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2所示的蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必须改变加热方式、冷凝方式,继续升高温度并收集205℃~206℃的馏分得产品A。
④将实验步骤②中保留待用的水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需 (仪器名称)。
(2)步骤②中饱和亚硫酸氢钠溶液洗涤是为了除去 ,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生的原因 。
(3)步骤③中无水硫酸镁的作用是 ,锥形瓶上要加塞的原因是 ,产品A为 。
(4)步骤③中蒸馏除去乙醚的过程中采用的加热方式为 ;蒸馏得产品A的加热方式是 。
(5)步骤④中提纯产品B时所用到的实验方法为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:选择题
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.0.1mol·L-1 NaHCO3溶液中:c(H+)+2c(H2CO3)=2c(CO32-)+c(OH-)
B.0.1mol·L-1(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
C.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-)
D.pH相等的①CH3COONa、②C6H5ONa、③Na2CO3、④NaOH四种溶液的物质的量浓度大小:①>②>③>④
查看答案和解析>>
科目:高中化学 来源:2014-2015河北枣强中学高一上学期期末考试化学试卷(解析版) 题型:填空题
(6分)根据下表信息回答以下问题:
元素 | A | B | C | D | E | F | G | H |
原子半径(nm) | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 | 0.154 | 0.037 | 0.099 |
主要化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
部分短周期元素的原子半径及主要化合价
(1)将A、D、E、F、H对应的简单离子按照半径由小到大的顺序填空________________。
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是____________________。
(3)实验室中制取H单质反应的化学方程式是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com