
合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g
2NH3(g ) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为
) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为 φ,下列说法中正确的是
φ,下列说法中正确的是
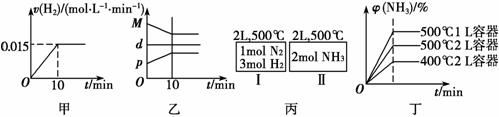
A.若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中 ,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器Ⅰ和Ⅱ达到平衡时所需要的时间可能不同
D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
科目:高中化学 来源: 题型:
下列化学反应对应的离子方程式表示正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+===Cu2++Fe2+
B.NH4HCO3溶于过量的NaOH溶液中:HCO +OH-===CO
+OH-===CO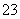 +H2O
+H2O
C.少量SO2通入苯酚钠溶液中: C6H5O-+SO2+H2O===C6H5OH+HSO
D.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
t℃时,水的离子积为KW。在该温度下,混合可溶性的一元酸HA和一元碱BOH的溶液,下列有关混合液的各种关系中,可确认混合液呈中性的是
A.pH=7 B.c(OH-)=c(H+)=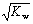
C.c(A-) > c(B+) D.c(H+)-c(OH-)=c(A-)-c(B+)
查看答案和解析>>
科目:高中化学 来源: 题型:
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.K2和K1的单位均为mol·L-1 B.K2>K1
C.c2(CO)=c2(H2O) D.c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2NO2 2NO+O2 在密闭容器中反应,达到平衡状态的标志是:( )
2NO+O2 在密闭容器中反应,达到平衡状态的标志是:( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B.②③⑤ C.①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个容积固定为2 L的密闭容器中,发生反应aA(g)+bB(g) pC(g) ΔH=?,反应情况记录如表:
pC(g) ΔH=?,反应情况记录如表:
| 时间 | c(A) (mol·L-1) | c(B) (mol·L-1) | c(C) (mol·L-1) |
| 0 | 1 | 3 | 0 |
| 第2 min[ | 0.8 | 2.6 | 0.4 |
| 第4 min | 0.4 | 1.8 | 1.2 |
| 第6 min | 0.4 | 1.8 | 1.2 |
请仔细分析,根据表中数据,回答下列问题:
(1)a=________,b=________,p=________。(取最小正整数)
(2)第2 min到第4 min内A的平均反应速率v(A)=________ mol·L-1·min-1。
(3)若从开始到第 4 min建立平衡时反应放出的热量为235.92 kJ,则该反应的ΔH=________。
4 min建立平衡时反应放出的热量为235.92 kJ,则该反应的ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示:
(1)“焙烧”过程中Al2(SO4)3和S发生反应的化学方程式为 ;
若生成102g Al2O3,转移的电子数目为 ;
(2)生成沉淀Ⅰ时的离子方程式为 ;
(3)写出化学式:沉淀Ⅱ是 ;
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是 ;
(5)从滤液中得到K2SO4晶体的方法是 ;
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的性质比较中,正确的是
A.酸性:HClO4>H3PO4>H2SO4 B.氢化物的稳定性:H2S>HF>H2O
C.碱性:Al(OH)3>Mg(OH)2>NaOH D.氧化性:F2>C12>Br2>I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com