
 如图是关于反应A2(g)+3B2(g)?2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
如图是关于反应A2(g)+3B2(g)?2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )| A、增大反应物浓度,同时减小生成物浓度 |
| B、降低温度,同时减压 |
| C、升高温度,同时加压 |
| D、增大反应物浓度,同时使用催化剂 |


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
| A、除掉淀粉胶体中的氯化钠(半透膜、蒸馏水、烧杯) |
| B、碘水中碘的萃取(分液漏斗、酒精、带铁圈的铁架台) |
| C、钠与水的反应(坩埚 镊子 小刀 ) |
| D、粗盐的提纯(蒸发皿、玻璃棒、温度计) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA |
| B、标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA |
| C、标准状况下,5.6L NO和5.6L O2组成的混合气体中所含原子数为NA |
| D、常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,相同体积的物质,其物质的量一定相等 |
| B、任何条件下,等物质的量的甲烷和一氧化碳所含的分子数相等 |
| C、1L CO一定比1L O2的质量小 |
| D、等压等体积的N2和CO2两种气体的分子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是( )
如图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是( )| A、H2Se |
| B、GeH4 |
| C、AsH3 |
| D、HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe+CuSO4═FeSO4+Cu | ||||
| B、AgNO3+NaCl═AgCl↓+NaNO3 | ||||
C、Fe2O3+3CO
| ||||
D、2KMnO4
|
查看答案和解析>>
科目:高中化学 来源: 题型:
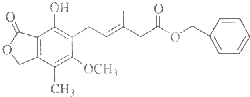 有关如图所示化合物的说法正确的是( )
有关如图所示化合物的说法正确的是( )| A、既可以与Br2的CCl4溶液发生加成反应,不能在光照下与Br2发生取代反应 |
| B、既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
| C、既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
| D、1mol该化合物最多可以与4mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列说法正确的是( )
下列说法正确的是( )| A、乙炔的标准燃烧热为-1299.6 kJ/mol,则乙炔燃烧的热化学方程式可表示为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(g)△H=-2599.2 kJ/mol | |||
B、500℃、30MPa下,将0.5 mol N2和1.5 molH2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| C、已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol,如图可表示由CO生成CO2的反应过程和能量关系 | |||
| D、已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ.已知1个 SF6(g)分子中含有6条S-F键.则:S(s)+3F2(g)═SF6(g)△H=-1220 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
| n(NO) |
| n(CO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com