
在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是 ( )

A.①加CCl4 ②加苯 ③加酒精
B.①加酒精 ②加CCl4 ③加苯
C.①加苯 ②加CCl4 ③加酒精
D.①加苯 ②加酒精 ③加CCl4
科目:高中化学 来源: 题型:
用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是 ( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊 | 饱和Na2CO3溶液 |
| B | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | 澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有Mn2+的酸性溶液中滴加过二硫酸钾(K2S2O8)溶液,会发生如下反应(未配平):Mn2++S2O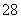 +H2O―→MnO
+H2O―→MnO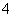 +SO
+SO +H+。下列说法正确的是( )
+H+。下列说法正确的是( )
A.该反应中起氧化作用的是Mn2+
B.反应后溶液的pH降低
C.反应中有1 mol还原剂参加反应,则转移的电子为4 mol
D.该反应常用于检验溶液中Mn2+的存在,现象是溶液紫红色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中含有一定量的杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。
已知:①氧化性:IO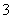 >Fe3+>I2;②KI+I2KI3
>Fe3+>I2;②KI+I2KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为四份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色沉淀的盐,可检验溶液中是否含有Fe2+,推测该蓝色沉淀是_______
(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:____________________、____________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:____________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质不适合作为食盐加碘剂,其理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:______________________、________________________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又 将Br2还原为Br-,其目的为________________________________________________________________________。
将Br2还原为Br-,其目的为________________________________________________________________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为________________________________________________________________________,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________________________________________________________________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称:________________;
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为________________________________________________________________________;
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________________________________________________________________________;
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①氯气的性质活泼,它与氢气混合后立即发生爆炸 ②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收 ③新制氯水的氧化性强于久置氯水的
④检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水中
A.①②③ B.②③④ C.③ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏伽德罗常数的值,下列叙述错误的是
A.2gD216O中含有的质子数、中子数、电子数均为NA
B.80g CuO和Cu2S的混合物含有铜原子数一定为NA
C.标准状况下,5.6L O2作氧化剂时转移电子数一定为NA
D.500mL 2mol·L-1Na2CO3溶液中含C微粒总数一定为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com