
| A. | 3:1:1:2 | B. | 2:2:2:1 | C. | 3:1:4:2 | D. | 2:1:1:1 |
分析 ①2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑~12e-;
②2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑~4e-;
③2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑~4e-;
④2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑~2e-;
制得相同质量的氧气,可假设得到3molO2,结合反应及转移的电子数计算.
解答 解:制得相同质量的氧气,可假设得到3molO2,则
①2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑~12e-;
3 12
②2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑~4e-;
3 12
③2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑~4e-;
3 12
④2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑~2e-;
3 6
所以制得相同质量的氧气,反应中电子转移数目之比为12:12:12:6=2:2:2:1,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,侧重氧化还原反应电子转移的考查,注意电子守恒的应用,明确反应中元素的化合价变化即可解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠、镁等金属着火,不可用CO2灭火 | |
| B. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| C. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| D. | 给试管中的液体加热时,不停沿试管倾斜方向移动试管或加入碎瓷片,以免液体暴沸伤人 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaX溶液的pH>7,则可证明HX属于弱电解质 | |
| B. | 二氯化铁溶液可以做电子工业中铜版的刻蚀液 | |
| C. | 实验室盛放NaF溶液不能用玻璃材质的试剂瓶及玻璃塞 | |
| D. | 浓的硫化钠溶液有强烈的臭味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
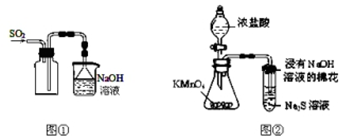
| A. | 实验室采用图①所示装置收集SO2 | |
| B. | 除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤 | |
| C. | 称取0.40 g NaOH,置于100 mL容量瓶中,加水溶解,配制0.10 mol/L NaOH溶液 | |
| D. | 可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生产过程中没有涉及到氧化还原反应 | |
| B. | 生产过程中没有涉及到置换反应 | |
| C. | 该厂生产的主要原料为煤、纯碱 | |
| D. | 该厂生产的最终产品是小苏打及烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 盐酸、硫酸和硝酸是中学常见的三种酸.
盐酸、硫酸和硝酸是中学常见的三种酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L lmol•L-1 FeBr2溶液与l molCl2反应时转移的电子数目为3NA | |
| B. | 7g分子式为CnH2n的链烃中含有的C-H键的数目为NA | |
| C. | 常温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 0.5mol•L-1硫酸钠溶液中含有溶质离子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{17}^{35}$Cl2与${\;}_{17}^{37}$Cl2氧化能力相近,二者互为同位素 | |
| B. | .过氧化氢的电子式: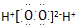 | |
| C. | .同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | .同周期主族元素原子半径随核电荷数的增大而减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com