
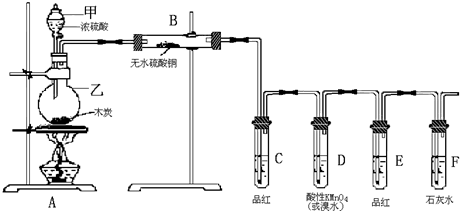
分析 (1)依据实验装置图中的仪器特点判断其名称;
(2)依据浓硫酸的强氧化性,在加热条件下能够与碳反应生成二氧化碳、二氧化硫气体和水;
(3)依据反应产物中的含二氧化碳、二氧化硫,检验二氧化碳的存在需要先除去二氧化硫,再进行二氧化碳气体的检验,防止二氧化硫对检验二氧化碳的干扰;
(4)F试管中是检验二氧化碳气体存在的装置,二氧化碳能使澄清石灰水变浑浊分析;
(5)根据溶液中含有水分,影响了水的测定分析.
解答 解:(1)依据装置图中操作的要求和图形分析,浓硫酸与木炭的反应需要把浓硫酸加入木炭加热反应,所以甲为分液漏斗,乙为圆底烧瓶,
故答案为:分液漏斗;圆底烧瓶;
(2)浓硫酸具有强氧化性,在加热条件下回合木炭发生氧化还原反应,生成二氧化碳、二氧化硫、水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H20,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H20;
(3)装置B是检验有水生成的装置,无水硫酸铜变蓝证明生成产物中含有水,气体通过C验证二氧化硫的生成,通过D是除去二氧化硫气体,E是验证二氧化硫气体是否除净,便于利用F装置检验二氧化碳气体的存在,要求气体通过E品红后不褪色,通过F石灰水变浑浊,才能证明气体中含有二氧化碳气体,
故答案为:气体通过E品红不褪色,通过F石灰水变浑浊;
(4)F装置中二氧化碳气体与氢氧化钙反应生成难溶物碳酸钙沉淀,反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O,
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O;
(5)溶液中含有水分,若若把B玻璃管移到F试管后连接,气体通过水溶液时会带出水蒸气,影响了水的测定,所以该方法不可行,
故答案为:不行;气体通过水溶液时,会带出水汽,干扰产物中水的确定.
点评 本题考查了浓硫酸的强氧化性的应用,题目难度中等,明确气体的性质及检验的先后顺序为解答关键,注意掌握浓硫酸的化学性质,能够正确书写浓硫酸与碳反应化学方程式.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 第IIA族中无非金属元素 | B. | 第IA族金属元素单质均能与水反应 | ||
| C. | 元素种类最多的族是第VIII族 | D. | 金属元素的种类比非金属元素多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
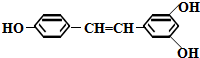 ,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )
,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )| A. | 13种 | B. | 15种 | C. | 17种 | D. | 19种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
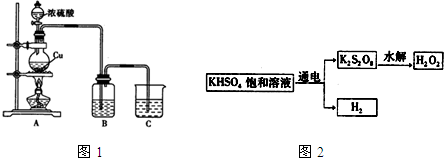
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 实验操作 | 主要现象 | 结论或解释 |
| 步骤1:取少量固体于试管中,加入足量 ①氯化铁溶液. | 固体减少且剩余, 淡黄色溶液变浅. | 固体中含有金属铁 |
| 步骤2:分离步骤1的剩余固体于另一试管中,加入足量 ②盐酸,将反应后溶液分成甲、乙两份. | 固体全部消失. | 反应的化学方程式 ③ Fe3O4+8HCl=FeCl2+2FeCl3+H2O. |
| 步骤3:在步骤2的甲溶液中加入几滴 ④高锰酸钾溶液. | 紫红色褪去. | 溶液中含有Fe2+. |
| 步骤4:在步骤2的乙溶液中加入几滴⑤KSCN溶液. | 溶液变成红色. | 溶液中含有Fe3+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸均能与钠反应生成氢气 | |
| B. | 煤的干馏、油脂的皂化和石油的分馏都属于化学变化 | |
| C. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 | |
| D. | 糖类、油脂、蛋白质均属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇完全燃烧生成水 | |
| B. | 乙醇容易挥发 | |
| C. | 乙醇能与水以任意比例互溶 | |
| D. | 0.1mol乙醇与足量金属钠反应生成0.05molH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com