
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| △c |
| △t |
| (0.6000-0.3000)mol/L |
| 2min |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |

| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C4(NO)C6(H20) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H20) |
| C4(NH3)C5(O2) |

| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | O |
| 第2min | 0.6 | a | O.2 |
| 第4min | O.3 | 0.975 | O.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | O.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度 时间 |
c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.4 | 0 | 0 |
| 第2min | 3.2 | 1 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
查看答案和解析>>
科目:高中化学 来源:2011届上海市卢湾区高三上学期期末考试化学试卷 题型:填空题
工业制硝酸的主要反应是:4NH3(g)+5O2(g)  4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
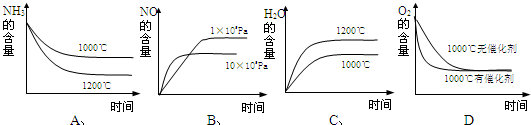
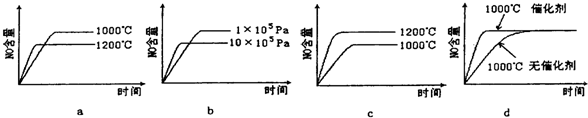
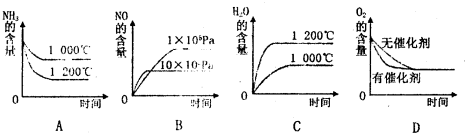
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填字母序号)。
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com