
【题目】利用沉淀滴定法快速测定NaBr等卤化物溶液中c(Br-),实验过程包括标准溶液的配制和滴定待测溶液。
I.标准溶液的配制
准确称取AgNO3基准物8.5g,配制成500mL标准溶液,放在棕色试剂瓶中避光保存,备用。
II.滴定的主要步骤
a.取待测NaBr溶液25.00mL,配制成100mL溶液,取其中25.00mL于锥形瓶中。
b.加入K2CrO4溶液作指示剂。
c.用AgNO3标准溶液进行滴定,记录消耗的体积。
d.重复上述操作三次,测定数据如下表:

e.数据处理。
请回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的玻璃仪器除烧杯和玻璃棒外还有___,配制的AgNO3溶液的浓度为___。
(2)AgNO3标准溶液应使用___ (填“酸式”或“碱式”)棕色滴定管,检漏后装液前需要进行的操作有___。
(3)实验可用铬酸钾(K2CrO4)作指示剂,一方面,是由于Ag2CrO4是砖红色沉淀,现象变化明显,另一方面,是由于___。
(4)滴定应在近中性或弱碱性(6.5<pH<10.5)的条件下进行,其原因是酸性过强,发生如下离子反应:___;碱性过强,会导致___。
(5)达到滴定终点时的现象为___。
(6)由上述实验数据测得原溶液c(Br-)=___ mol·L-1。
(7)若在配制AgNO3标准溶液时,未洗涤玻璃棒和烧杯,则对c(Br-)测定结果的影响为___ (填“偏高”“偏低”或“无影响”)。
【答案】500 mL(棕色)容量瓶、胶头滴管 0.1mol/L 酸式 洗涤、润洗 AgBr比Ag2CrO4更难溶,在相同浓度的Ag+溶液中Br-比CrO42-更易结合Ag+生成沉淀 2CrO42-+2H+![]() Cr2O72-+H2O Ag+易结合OH-生成Ag2O沉淀,影响实验测定 滴入最后一滴标准溶液,锥形瓶中产生了砖红色沉淀,且30 s内不消失 0.4 偏高
Cr2O72-+H2O Ag+易结合OH-生成Ag2O沉淀,影响实验测定 滴入最后一滴标准溶液,锥形瓶中产生了砖红色沉淀,且30 s内不消失 0.4 偏高
【解析】
该滴定实验的原理为:根据反应Br-+Ag+=AgBr↓,通过消耗的硝酸银标准液的量来确定待测液中Br-的量,当Br-完全反应后,继续滴加硝酸银,银离子与CrO42-反应生成砖红色沉淀,即可确定滴定终点。
(1)配制硝酸银标准溶液时,所使用的玻璃仪器除需烧杯和玻璃棒外还有500 mL(棕色)容量瓶及定容时需要的胶头滴管;c(AgNO3)=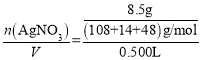 =0.1mol/L;
=0.1mol/L;
(2)AgNO3溶液显酸性,且一般加少量HNO3酸化,需用酸式滴定管;检漏后装液前需要进行洗涤、润洗等操作;
(3)实验可用铬酸钾(K2CrO4)作指示剂,说明AgBr比Ag2CrO4更难溶,在相同浓度的Ag+溶液中Br-比CrO42-更易结合Ag+生成沉淀;
(4)酸性过强,指示剂CrO42-会转变为Cr2O72-,从而影响滴定终点的判断离子方程式为:2CrO42-+2H+![]() Cr2O72-+H2O;碱性过强,Ag+易生成Ag2O沉淀,影响实验测定结果;
Cr2O72-+H2O;碱性过强,Ag+易生成Ag2O沉淀,影响实验测定结果;
(5)根据分析可知,滴定终点的现象为:滴入最后一滴标准溶液,锥形瓶中产生了砖红色沉淀,且30 s内不消失;
(6)根据所提供的4次数据,第1次数据误差值较大,应舍去,所以消耗的AgNO3溶液的平均体积为![]() =25.00mL,根据方程式Br-+Ag+=AgBr↓可知稀释后的NaBr溶液中c(Br-)=
=25.00mL,根据方程式Br-+Ag+=AgBr↓可知稀释后的NaBr溶液中c(Br-)=![]() =0.1mol/L,该溶液是由25mL稀释成100mL,所以原溶液中c(Br-)=0.4mol/L;
=0.1mol/L,该溶液是由25mL稀释成100mL,所以原溶液中c(Br-)=0.4mol/L;
(7)若在配制AgNO3标准溶液时,未洗涤玻璃棒和烧杯,会导致硝酸银标准液的浓度偏低,从而使测定的标准液体积偏大,进而使溴离子浓度偏大。


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知在柑橘、柠檬等水果中含有柠檬酸,且已知柠檬酸中只含C、H、O三种元素。取柠檬酸19.2g,在氧气中完全燃烧,产生CO2和H2O分别为26.4g和7.2g,现对该物质进行质谱分析,可获得柠檬酸的相对分子质量为192,利用红外光谱分析可知柠檬酸分子中含有﹣COOH和﹣OH。请回答:
(1)通过计算,可获得柠檬酸的分子式为_____。
(2)再利用核磁共振氢谱分析发现有4个吸收峰,其峰面积之比为4:2:1:1.综合以上信息,写出柠檬酸的结构简式_____。
(3)柠檬酸与有机物C在一定条件下发生酯化反应可生成一种相对分子质量为220的酯类物质。写出C所有可能的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠与工农业生产、日常生活紧密相关。工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品往往含有少量的NaCl,现欲测定碳酸钠样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀________(填操作名称)、洗涤、烘干、称量。洗涤沉淀的操作是________________________________________.
方案二:气体分析法
(2)用如图所示装置,将一定质量的样品与足量盐酸反应,并测定产生CO2气体的体积,为了使测量结果准确,B中的溶液最好采用________(填字母)。
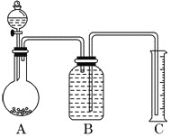
a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液
c.饱和氢氧化钠溶液 d.氯化钠溶液
但选用该溶液后实验结果仍然不够准确,原因是________________________________
方案三:质量差分析法
(3)采用如图所示装置,将一定质量的样品与足量的稀硫酸反应,通过称量反应前后盛有碱石灰的干燥管的质量,利用其质量差计算样品的纯度。
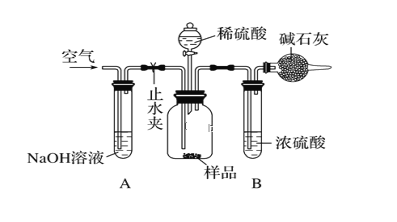
该实验的操作步骤:
①在干燥管内装满碱石灰,质量为m1g ②取ng样品装入广口瓶中 ③检查装置的气密性 ④缓慢鼓入空气数分钟,再称量干燥管质量为m2g ⑤关闭止水夹 ⑥打开止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓入空气数分钟
Ⅰ.正确的操作顺序是(填序号):③→_____→⑥→_____→⑤→________→⑦→________→④。
Ⅱ.在操作④中,要缓慢鼓入空气数分钟,鼓入空气的作用是________________;装置 B的作用是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:mCeO2 (m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2
(m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO

下列说法不正确的是( )
A.该过程中CeO2没有消耗B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3D.H2(g)+O2(g)=H2O(g)的反应热大于ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①由非金属元素组成的化合物一定是共价化合物 ②离子化合物一定含离子键,可能含极性键或非极性键 ③非极性键既可能存在于单质和共价化合物中,也可能存在于离子化合物中 ④所有化合物都含有化学键 ⑤元素形成化合物时,不一定都达到稀有气体元素原子的电子层结构 ⑥任何元素的原子都是由核外电子和核内中子、质子组成的⑦化学反应一定伴随着能量的变化 ⑧质子数相同的微粒一定属于同种元素
A.②③④⑤⑦B.②③⑤⑦⑧C.①③④⑥⑦D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z 四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
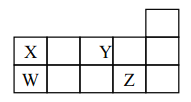
A. 四种元素中原子半径最大为 W, Y 的氢化物稳定性最强
B. 四种元素最高价氧化物的水化物都是酸
C. XZ4、 WY2中所含化学键类型相同,熔点都很高
D. W、 X 形成的单质都是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数之和为17,其中W、X、Y三种元素的简单离子的核外电子排布相同,且可形成结构如图所示的化合物。下列说法正确的是( )
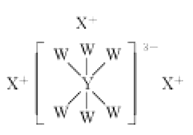
A.X、Y、Z的最高价氧化物对应水化物两两之间均能反应
B.X与Z形成的化合物会抑制水的电离
C.W的简单气态氢化物的热稳定性比Z的弱
D.原子半径: Z>Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与消耗的HC1物质的量关系如图所示(忽略气体的溶解和HC1的挥发).下列说法不正确的是
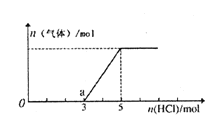
A. 0点溶液中所含溶质的化学式为NaOH、Na2CO3
B. 0到a点发生反应的离子方程式:H++OH-=H2O、CO32-+H+=HCO3-
C. 通入CO2气体的体积在标准状况下为22.4L
D. NaOH溶液的物质的量浓度为2.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯: 6 H2(g) +2CO2(g)![]() CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
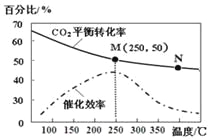
A. 生成乙烯的速率:v(M)一定小于v(N)
B. 化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D. 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com