
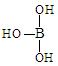
 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:  口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.零族元素的单质在常温下都是气体 |
| B.第ⅡA族元素都是金属元素 |
| C.Fe位于周期表的第四周期,第ⅧB族 |
| D.第ⅦA族元素的单质在常温下有气态、液态、固态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.s电子的原子轨道都是球形的,2s电子比1s电子能量高且电子云比1s更扩散 |
| B.p电子的原子轨道都是哑铃形的,每个p能级有3个原子轨道,它们相互垂直能量不同 |
| C.当电子排布在同一能级的不同轨道,总是优先单独占据一个轨道,而且自旋方向相同 |
| D.在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋方向相反 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:
D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为: 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 电离能/kJ·mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| | NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
 案:
案:
 100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱性:NaOH>Mg(OH)2>Al(OH)3 | B.还原性:Na>Mg>Al |
| C.相对原子质量:Al>Mg>Na | D.氧化性:Al3+>Mg2+>Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:甲<乙 甲 乙 丙 丁 戊 |
| B.非金属性:乙<丁 |
| C.最高价氧化物的水化物的酸性:丙<丁 |
| D.最外层电子数:丙>丁>戊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com