

分析 B是常见的金属,且B的合金用量最大,B为Fe,由B+盐酸→D+H2可知,D为FeCl2,E在常温下是黄绿色气体,E为Cl2,FeCl2与Cl2反应生成F为FeCl3,FeCl3溶液可以与Fe反应生成FeCl2.A是常见的金属,由A+盐酸→C+H2,C为金属氯化物,C与氢氧化钠反应生成白色沉淀,可以溶于氢氧化钠、盐酸,故该白色沉淀为Al(OH)3,故C为AlCl3,A为Al.
解答 解:B是常见的金属,且B的合金用量最大,B为Fe,由B+盐酸→D+H2可知,D为FeCl2,E在常温下是黄绿色气体,E为Cl2,FeCl2与Cl2反应生成F为FeCl3,FeCl3溶液可以与Fe反应生成FeCl2.A是常见的金属,由A+盐酸→C+H2,C为金属氯化物,C与氢氧化钠反应生成白色沉淀,可以溶于氢氧化钠、盐酸,故该白色沉淀为Al(OH)3,故C为AlCl3,A为Al.
(1)由上述分析可知,A是Al,故答案为:Al;
(2)A溶于NaOH溶液的化学方程式是:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)检验FeCl3中金属阳离子的常用方法是:检验FeCl3中金属阳离子的常用方法是:取少许溶液,加入KSCN溶液,若溶液变红色,则含有Fe3+,
故答案为:取少许溶液,加入KSCN溶液,若溶液变红色,则含有Fe3+;
(4)D转化为F的离子反应方程式是:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:2Fe2++Cl2═2Fe3++2Cl-.
点评 本题考查无机物推断,涉及Fe、Al等元素单质化合物性质及转化关系,B的合金用量最大,E在常温下是黄绿色气体,白色沉淀可以溶于氢氧化钠与盐酸等均为解题突破口,难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②③ | C. | 只有②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用锌粒和稀硫酸制H2 | B. |  用H2O2和MnO2制O2 | ||
| C. | 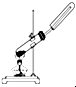 用氯化铵和氢氧化钙固体制NH3 | D. |  用铜片和稀硝酸制NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol丙烷共用电子对数为6NA | |
| B. | 1mol甲醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为2NA | |
| C. | 标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为$\frac{8}{22.4}$NA | |
| D. | 0.1mol甲烷和0.1mol乙酸完全燃烧消耗的O2分子数都为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | CO、SO2、SO3均是酸性氧化物 | |
| B. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| C. | 漂白粉的有效成分为Ca(ClO)2 | |
| D. | 除去与水反应的两个反应,图示其余转化反应均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定含CO32- | |
| B. | 某无色溶液滴入酚酞试液显红色,该溶液呈碱性 | |
| C. | 某溶液中滴加BaCl2溶液生成不溶于稀硝酸的白色沉淀,该溶液可能含有SO42- | |
| D. | 验证烧碱溶液中是否含Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂 | 湿润的试纸 | 现象 | 结论 |
| A | Na2SO3,浓硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
| C | 碘水 | 淀粉试纸 | 变蓝 | 碘具有氧化性 |
| D | Cu,浓硝酸 | 淀粉-KI试纸 | 变蓝 | NO2为酸性气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com