
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用溴水或酸性高锰酸钾溶液可以鉴别1-己烯和乙醛 |
分析 A.钠和乙醇反应生成氢气,和乙醚不反应;
B.己烷和酸性高锰酸钾溶液不反应,3-己烯能被酸性高锰酸钾溶液氧化;
C.水和苯、溴苯都不互溶,但苯密度小于水,溴苯密度大于水;
D.1-己烯和乙醛都能与溴水、酸性高锰酸钾溶液反应.
解答 解:A.钠和乙醇反应生成氢气,和乙醚不反应,现象不同,可以鉴别,故A正确;
B.己烷和酸性高锰酸钾溶液不反应,3-己烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以现象不同,可以鉴别,故B正确;
C.水和苯、溴苯都不互溶,但苯密度小于水,溴苯密度大于水,所以混合时现象不同,可以鉴别,故C正确;
D.1-己烯和乙醛都能与溴水、酸性高锰酸钾溶液反应,所以都能使溴水、酸性高锰酸钾溶液褪色,现象相同,不能鉴别,故D错误;
故选D.
点评 本题考查有机物鉴别,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,易错选项是D,注意醛基能被溴、酸性高锰酸钾溶液氧化.


科目:高中化学 来源: 题型:解答题
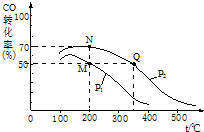 减少污染、保护环境是全世界最热门的课题.
减少污染、保护环境是全世界最热门的课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlO2-、SO42-、Cl-、K+ | B. | Al3+、Ca2+、HCO3-、Na+ | ||
| C. | Fe3+、NH4+、SO42-、SCN- | D. | H+、Cl-、Na+、HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-c=m-n | B. | a-b=n-m | C. | c+d=m+n | D. | b-d=n+m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
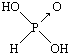
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH |  | 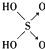 | 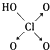 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 和
和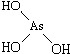 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑥ | C. | ①②④⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com