
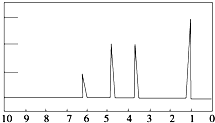
 1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的1H核磁共振谱如图所示:则该物质可能是下列中的( )
1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的1H核磁共振谱如图所示:则该物质可能是下列中的( )| A. | CH3CH2CH3 | B. | CH3CH2CH2OH | C. | CH3CH2CH2CH3 | D. | CH3CH2OH |
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 111 | B. | 161 | C. | 272 | D. | 433 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Cl | C. | K | D. | S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1:2:1 | B. | 1:3:2:2 | C. | 3:1:2:2 | D. | 1:3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1-a}{7}$ | B. | $\frac{3}{4}$a | C. | $\frac{6}{7}$(1-a) | D. | $\frac{12}{13}$(1-a) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的沸点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
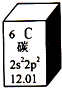 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的原子序数为6 | |
| B. | 该元素所有原子的质子数均为6 | |
| C. | 该元素的相对原子质量为12.01 | |
| D. | 该元素没有同位素,所有原子的中子数均为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
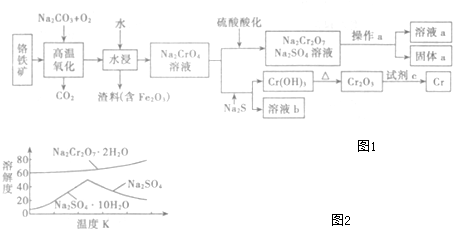
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com