
【题目】氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一。
(1)氨催化氧化法是工业制硝酸的主要方法。
已知:2NO(g)+3H2(g)![]() 2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1, 2H2(g)+O2(g)═2H2O(g) △H2= -483.6kJ·mol-1,则4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3= 。
2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1, 2H2(g)+O2(g)═2H2O(g) △H2= -483.6kJ·mol-1,则4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3= 。
(2)恒容密闭容器中进行合成氨反应N2(g) +3H2(g) ![]() 2NH3(g) △H4 = - 92. 4 kJ·mol-1,
2NH3(g) △H4 = - 92. 4 kJ·mol-1,
ΔS=-198.2Jmol-1K-1。其化学平衡常数(K)与温度的关系如下表:
温度/K | 398 | 498 | … |
平衡常数(K) | K1 | K2 | … |
K1 K2(填“>”或“<”),请分析,298K时,合成氨反应能否自发进行 。
(3) 向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。下列说法正确的是 (填字母)。
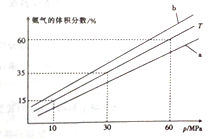
A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为 。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为 。
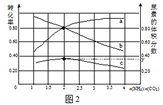
(5)氨碳比[n(NH3)/n(CO2)]对合成尿素的反应:2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数。[n(NH3)/n(CO2)] 时,尿素产量最大;该条件下反应的平衡常数K= 。
CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数。[n(NH3)/n(CO2)] 时,尿素产量最大;该条件下反应的平衡常数K= 。
【答案】
(1)-905.0kJ·mol-1
(2)>;能自发进行。
(3)AB;50%
(4)77.8%
(5)2;40
【解析】
试题分析:(1)已知:①2NO(g)+3H2(g)![]() 2NH3(g)+O2(g)△H1=-272.9 kJ·mol-1,②2H2(g)+O2(g)═2H2O(g)△H2= -483.6kJ·mol-1,根据盖斯定律,将②×3-①×2,得4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3=(-483.6kJ·mol-1)×3-(-272.9 kJ·mol-1)×2=-905.0kJ·mol-1,故答案为:-905.0kJ·mol-1
2NH3(g)+O2(g)△H1=-272.9 kJ·mol-1,②2H2(g)+O2(g)═2H2O(g)△H2= -483.6kJ·mol-1,根据盖斯定律,将②×3-①×2,得4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3=(-483.6kJ·mol-1)×3-(-272.9 kJ·mol-1)×2=-905.0kJ·mol-1,故答案为:-905.0kJ·mol-1
(2) N2(g) +3H2(g) ![]() 2NH3(g) △H4 = - 92. 4 kJ·mol-1,反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,因此K1>K2,298K时,△G=△H-T△S=(- 92. 4 kJ·mol-1)-298K×(-198.2Jmol-1K-1)=-33.3 kJ·mol-1<0,能自发进行,故答案为:>;能自发进行。
2NH3(g) △H4 = - 92. 4 kJ·mol-1,反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,因此K1>K2,298K时,△G=△H-T△S=(- 92. 4 kJ·mol-1)-298K×(-198.2Jmol-1K-1)=-33.3 kJ·mol-1<0,能自发进行,故答案为:>;能自发进行。
(3)A.N2(g) +3H2(g) ![]() 2NH3(g),增大体系压强(p),平衡正向移动,有利于增大氨气在混合气体中的体积分数,正确;B.N2(g) +3H2(g)
2NH3(g),增大体系压强(p),平衡正向移动,有利于增大氨气在混合气体中的体积分数,正确;B.N2(g) +3H2(g) ![]() 2NH3(g) △H4 = - 92. 4 kJ·mol-1,反应为放热反应,降低温度,平衡正向移动,氨气在混合气体中的体积分数增大,若图中T=500℃,则温度为450℃时对应的曲线是b,正确;C.工业上采用500℃温度是因为催化剂的活性在该温度下较强,和加快反应速率,但不利于提高氮气的转化率,错误;D.当2v正(H2)=3v逆(NH3)时,反应达到平衡状态,错误;故选AB;设生成氨气的物质的量为x,则反应的氮气的物质的量为
2NH3(g) △H4 = - 92. 4 kJ·mol-1,反应为放热反应,降低温度,平衡正向移动,氨气在混合气体中的体积分数增大,若图中T=500℃,则温度为450℃时对应的曲线是b,正确;C.工业上采用500℃温度是因为催化剂的活性在该温度下较强,和加快反应速率,但不利于提高氮气的转化率,错误;D.当2v正(H2)=3v逆(NH3)时,反应达到平衡状态,错误;故选AB;设生成氨气的物质的量为x,则反应的氮气的物质的量为![]() ,则
,则![]() =25%,x=10mol,N2的转化率为
=25%,x=10mol,N2的转化率为![]() ×100%=50%,故答案为:AB;50%
×100%=50%,故答案为:AB;50%
(4)由4NH3 + 5O2 ![]() 4NO + 6H2O 、4NO + 3O2 + 2H2O = 4HNO3可得:NH3 + 2O2 = HNO3 + H2O,则按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则生成1molHNO3、molH2O,则硝酸的质量分数为:
4NO + 6H2O 、4NO + 3O2 + 2H2O = 4HNO3可得:NH3 + 2O2 = HNO3 + H2O,则按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则生成1molHNO3、molH2O,则硝酸的质量分数为:![]() ×100%=77.8%,故答案为:77.8%;
×100%=77.8%,故答案为:77.8%;
(5)由图可知,横坐标为n(NH3)/n(CO2)=2时,尿素的体积分数最大,且y点氨气的转化率为80%,
2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)
CO(NH2)2(g)+H2O(g)
起始浓度(mol/L) 1 0.5 0 0
变化浓度(mol/L) 0.8 0.4 0.4 0.4
平衡浓度(mol/L) 0.2 0.1 0.4 0.4
平衡常数K=![]() =40,故答案为:2;40。
=40,故答案为:2;40。


科目:高中化学 来源: 题型:
【题目】某有机化合物A 对氢气的相对密度为29,燃烧该有机物2.9g,生成3.36L二氧化碳气体(密度为1.977g/L)
(1)求该有机化合物的分子式;
(2)取0.58 g该有机化合物与足量银氨溶液反应,析出金属银2.16g。写出该化合物的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图为实验室制备、收集少量HCl的装置。
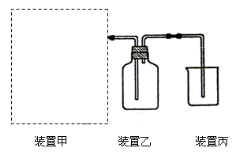
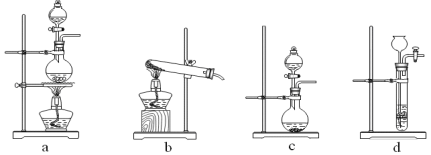
① 制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的 。
② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因 。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 。
(2)以下为苯的取代反应的探究实验。

①按上图所示的装置图连接好各仪器。
②检验装置的气密性。
③在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式 。装置C的作用是 。
④反应结束后,用试管取少量D中的溶液,加入
(描述试剂和现象),则证明B中的取代反应已经发生。
⑤把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。其中试剂为 ,操作名称为 。
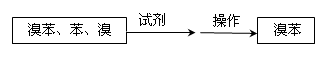
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把任意比的NaHCO3和Na2O2的混合物放在密闭容器中加热.关于混合物加热前后消耗盐酸的物质的量,下列结论判断正确的是( )
A.加热前后一样多 B.加热前消耗的多
C.加热后消耗的多 D.当Na2O2适量时才会一样多无法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PM2.5是指大气中直径或小于或等于2.5微米的颗粒物,也叫可入肺颗粒物,与肺癌、哮喘等疾病的发生密切相关,是灰霾天气的主要原因,它来自它主要来自化石燃料的燃烧(如机动车尾气、燃煤)等列与PM2.5相关的说法不正确的是( )
A. 大力发展电动车,减少燃油汽车的尾气排放量
B. 开发利用各种新能源,减少对化石燃料的依赖
C. 多环芳烃是强致癌物,能吸附在PM2.5的表面进入人体
D. PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.垃圾是放错地方的资源,应分类回收利用
B.实现化石燃料清洁利用,就无需开发新能源
C.为提高农作物的产量和质量,应大量使用化肥和农药
D.将废弃的植物油(即“地沟油”)蒸馏可以重新作为食用油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯(简称DMC)是一种绿色化学品,可取代光气等有毒物质作为羰基化或甲基化试剂,如:
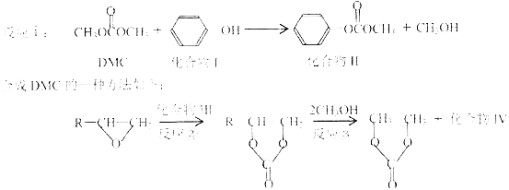
(1)化合物II核磁共振氢谱有 组峰;1mol该物质最多可以跟 mol氢气发生加成反应。
(2)反应①中副产物甲醇发生催化氧化反应的方程式为 。
(3)反应②原子利用率100%,则化合物Ⅲ的名称是 。化合物Ⅳ的结构简式是 ,反应③的反应类型是 。
(4)化合物V是化合物Ⅱ的一种同分异构体,其苯环上的一氯代物有两种,且能发生水解反应和银镜反应,则化合物V的结构简式为(写其中一种) 。
(5)一定条件下,![]() 与DMC 以物质的量之比为1∶1发生类似反应①的反应,请写出该反应的化学方程式 。
与DMC 以物质的量之比为1∶1发生类似反应①的反应,请写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用“组合转化”等技术对CO2进行综合利用。如用H2 和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g)![]() C2H4 (g)+4H2O(g) △H= a kJ/mol
C2H4 (g)+4H2O(g) △H= a kJ/mol
(1)已知:①H2和C2H4的燃烧热分别为285.8kJ/mol和1411kJ/mol
②H2O(g)= H2O(l) △H= - 44 kJ/mol
则a= kJ/mol。
(2)不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法错误的是 ____________(填序号)。
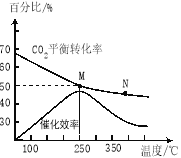
①M点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④为提高 CO2的转化率应在尽可能低的温度下进行反应
(3)若在密闭容器中充入体积比为 3∶1的H2和CO2,则图中M点时,产物C2H4的体积分数为 ;若要进一步提高乙烯的体积分数,可采取的措施有 。
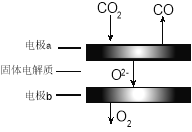
(4)利用高温电解技术可将CO2转化为高热值的燃料CO气体。
① 电极a发生的反应类型是 (填“氧化”或“还原”)反应。
② 高温电解的总反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】唐代刘禹锡撰于818年的传信方中有这样一段描述“治气痢巴石丸,取白矾一大斤。以炭火净地烧令汁尽,则其色如雪,谓之巴石”。据此推测,用于治气痢巴石丸,其主要原料的化学成分为
A.CuSO4 B.FeSO4﹒7H2O C.KAl(SO4)2﹒7H2O D.Fe2(SO4)3﹒7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com