
| A、CaO+H2O═Ca(OH)2△H<0,故可把该反应设计成原电池 |
| B、某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置盐桥中为装有含琼胶的KCl饱和溶液 |
| C、原电池的两极一定是由活动性不同的两种金属组成 |
| D、理论上说,任何能自发进行的氧化还原反应都可设计成原电池 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、欲配制1.00L1.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
| B、电解58.5g熔融的NaCl,能产生22.4LCl2(标准状况)、23.0g金属钠 |
| C、5.6gFe与足量Cl2反应,失去电子数为0.3NA |
| D、常温下,1 L0.1mol/LAlCl3中含Al3+数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①是BaCl2溶液,②是稀盐酸 |
| B、①是AgNO3,②是HNO3溶液 |
| C、①是稀HNO3,②是AgNO3溶液 |
| D、①是稀H2SO4,②是AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、17g的OH- 离子中含有的电子数为9NA |
| B、常温常压下,18 g H2O 中含有的原子总数为3NA |
| C、1mo1?L-1的A1C13溶液中,C1-离子的数目为3 NA |
| D、2.24 L四氯化碳分子中含有的分子数0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
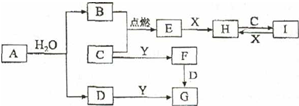 有关物质的转化关系如图所示(部分物质和条件己略去).B、C、E;是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应:G的焰色反应显黄色;I的溶液呈黄色.
有关物质的转化关系如图所示(部分物质和条件己略去).B、C、E;是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应:G的焰色反应显黄色;I的溶液呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量Cl2用于饮用水消毒 |
| B、氧化铝用于制造耐火材料 |
| C、Na2O2用于呼吸面具中供氧 |
| D、Si用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L的CaCl2溶液中含Cl-的数目为2NA |
| B、标准状况下,22.4LCl2和H2混合气体原子数为2NA |
| C、0.1mol AlCl3完全转化为氢氧化铝胶体,会生成0.1NA个胶粒 |
| D、常温常压下,100g 17% H2O2水溶液含氧原子总数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com