
【题目】下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:
。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。
【答案】(1)Ar
(2)HClO4
(3)非电解质;![]()
(4)Al2O3+ 2OH—= H2O + 2AlO2—
(5)离子键、共价键;2Na2O2+ 2CO2= 2Na2CO3+ O2↑
【解析】试题分析:由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar。
(1)稀有气体Ar的化学性质最不活泼,则化学性质最不活泼的为Ar。
故答案为:Ar;
(2)以上元素中,最高价氧化物对应水化物的酸性最强的为高氯酸,化学式为HClO4。
故答案为:HClO4;
(3)②的氢化物为NH3,氨气为非电解质;元素⑦与④形成化合物为NaCl,氯化钠为离子化合物,其电子式为:![]() 。
。
故答案为:非电解质;![]() ;
;
(4)⑤为Al元素,其最高价氧化物为氧化铝,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-=H2O+2AlO2-。
故答案为:Al2O3+2OH-=H2O+2AlO2-;
(5)元素④的某氧化物可作供氧剂,该氧化物为过氧化钠,过氧化钠中所含的化学键类型有离子键和共价键;过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2。
故答案为:离子键、共价键;2Na2O2+2CO2=2Na2CO3+O2。


科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:

回答下列问题:
(1)A的化学名称为_____由A生成B的反应类型为_____。
(2)C的结构简式为_____。
(3)富马酸的结构简式为_____。
(4)检验富血铁中是否含有Fe3+的实验操作步骤是_____。
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出____L CO2(标况);富马酸的同分异构体中,同为二元羧酸的还有____________(写出结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化关系如图所示,已知A为中学化学常见的非金属单质固体,E为常见的金属单质,反应过程中部分产物略去。

(1)写出棕黄色溶液中溶质的化学式 。
(2)写出B→C的化学反应方程式 。
(3)写出F→H在酸性溶液中发生的离子反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐R的化学工为XmYnZp(X、Y、Z为三种不同离子),其组成元素均为短周期元素,取两份等质量等浓度R的水溶液各5 mL进行如下实验:
Ⅰ.取一份R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,最终剩余沉淀甲4.66g,且甲不溶于稀盐酸。
Ⅱ.取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.224L(标准状况),乙能使湿润的红色石蕊试纸变蓝。
据此回答:
(1)写出R和甲的化学式:R ;甲 。
(2)另取500mL R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示。则:
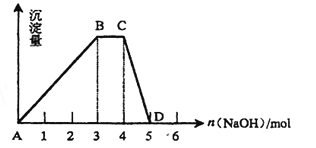
①R溶液的物质的量浓度为 。
②BC段表示的含义是 。
③CD段表示的含义是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同:D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25。
(1)F基态原子的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是(用元素符号回答) 。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知;还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图。下列说法正确的是()

A.反应过程中的氧化产物均为Na2SO4
B.a 点时消耗NaHSO3的物质的量为1.0mol
C.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
D.当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用下图装置进行乙酸乙酯合成和分离的实验探究,请回答以下问题

(1)写出合成乙酸乙酯的化学方程式____________________________________。
(2)仪器b的名称________,图中起冷凝回流作用的是______(填a、b、c、d、e)。
(3)为了提高乙酸乙酯的产率可采取的措施 ___________________________________
(4)经过0.5h加热反应后,将反应装置c中粗产品转移至d中进行蒸馏
物质 | 98.3%浓硫酸 | 乙酸乙酯 | 乙酸 | 乙醇 | 乙醚 | 水 |
沸点 | 338℃, | 77.1℃ | 118℃ | 78.5℃ | 34.6℃ | 100℃ |
根据上表分析,蒸馏后得到的乙酸乙酯中,最有可能含有________________杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是谁处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
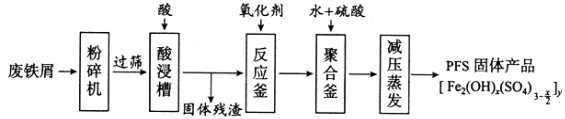
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
A.KMnO4 B.![]() C.
C.![]() D.
D.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________
,已知该样品中Fe的质量分数w,则B的表达式为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com