
【题目】现有部分元素的原子结构特点如表:
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 最外层电子数是次外层电子数的2.5倍 |
(1)画出W原子结构示意图________________________。
(2)元素X与元素Z相比,非金属性较强的是________(填元素名称),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:________________________________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为____________________。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,写出Q的电子式________。元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的、且在自然界中稳定存在的物质,写出该反应的化学方程式:____________________________________。
【答案】![]() 氧2H2S+O2===2H2O+2S↓NH4HSO4
氧2H2S+O2===2H2O+2S↓NH4HSO4![]() N2H4+2H2O2
N2H4+2H2O2![]() N2+4H2O
N2+4H2O
【解析】
X元素的L层电子数是K层电子数的3倍,根据核外电子排布的规律,推出X为O,Y元素核外电子层数等于原子序数,推出Y为H,Z元素L层电子数是K层和M层电子数之和,推出Z为S,W元素最外层电子数是次外层电子数的2.5倍,推出W为N。
根据核外电子排布规律,X元素的L层电子数是K层电子数的3倍,根据核外电子排布的规律,推出X为O,Y元素核外电子层数等于原子序数,推出Y为H,Z元素L层电子数是K层和M层电子数之和,推出Z为S,W元素最外层电子数是次外层电子数的2.5倍,推出W为N,(1)W为N,其原子结构示意图为![]() ;(2)X为O,Z为S,比较两者的非金属性,一般通过置换反应进行比较,2H2S+O2=2H2O+2S,氧气的氧化性强于S,即O的非金属性强于S;(3)这四种元素组成化合物是离子化合物,该化合物为铵盐,水溶液显酸性,应是酸式盐,即化学式为NH4HSO4;(4)X和Y以原子个数比为1:1化合形成的化合物是H2O2,其结构式为H-O-O-H,电子式为
;(2)X为O,Z为S,比较两者的非金属性,一般通过置换反应进行比较,2H2S+O2=2H2O+2S,氧气的氧化性强于S,即O的非金属性强于S;(3)这四种元素组成化合物是离子化合物,该化合物为铵盐,水溶液显酸性,应是酸式盐,即化学式为NH4HSO4;(4)X和Y以原子个数比为1:1化合形成的化合物是H2O2,其结构式为H-O-O-H,电子式为![]() ;H2O2的电子总数为18,M化合物是由N和H组成的18电子微粒,即为N2H4,生成无毒物质,即N转化成N2,H转化成H2O,即化学反应方程式为N2H4+2H2O2
;H2O2的电子总数为18,M化合物是由N和H组成的18电子微粒,即为N2H4,生成无毒物质,即N转化成N2,H转化成H2O,即化学反应方程式为N2H4+2H2O2![]() N2+4H2O。
N2+4H2O。


科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
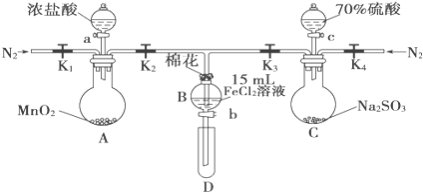
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________。
(2)实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是__________________________。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的化学方程式__________________________。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为__________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示.他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是_____(填“甲”、“乙”或“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有Fe2+ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有SO42﹣ |
(6)将B中的FeCl2溶液换成100mLFeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有1/2的Br﹣被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转换关系 (部分反应中得水已忽略)

(1)若A为氯碱工业的产品,C为厨房中的用品。
①反应Ⅰ的离子方程式为____________________________________________;
②氯碱工业制备A的化学方程式是__________________________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①B溶液可净水的原因是____________________________________________;
②A的实验制法的化学方程式____________________________________________。
(3)若B是一种两性氢氧化物,请写出反应Ⅲ的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨烯(单层石墨)中含有C-C键的数目为3NA
C.60gSiO2中含Si—O键的个数为2NA
D. 六方最密堆积的配位数是12,空间利用率是74%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:( )
①Cl-的结构示意图
②羟基的电子式:![]()
③HClO的结构式:H—Cl—O
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化( )
A. ①②⑤ B. ①④⑥⑦ C. ②③④⑥ D. ②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钾都是重要的工业产品。请回答下列问题:
(1)工业冶炼铝的化学方程式是_________________。阴极反应式:__________。
若阳极转移电子0.6 mol生成Al的质量是________ g。
(2)铝与氢氧化钾溶液反应的离子方程式是_____________________________。
(3)工业产品氢氧化钾的溶液中含有某些含氧酸根离子,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),工作原理如下图所示。
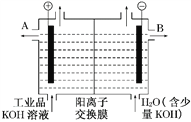
①该电解槽的阳极反应是__________________。
②通电开始后,阴极附近溶液pH会增大,原因为___________________________
③除去杂质后的氢氧化钾溶液从液体出口________(填“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com