

分析 铁铝合金(含Fe、Al、Fe2O3、Al2O3)中加入盐酸,铁、铝与盐酸反应生成气体X为氢气,得到的溶液Y中含有Al3+、Fe3+、Fe2+,在Y中加入过量的氢氧化钠得固体Z为氢氧化铁和氢氧化亚铁,溶液W中含有偏铝酸根离子,Z在足量空气中生成固体M为氢氧化铁,氢氧化铁加热分解得铁红Fe2O3,以此来解答.
解答 解:铁铝合金(含Fe、Al、Fe2O3、Al2O3)中加入盐酸,铁、铝与盐酸反应生成气体X为氢气,得到的溶液Y中含有Al3+、Fe3+、Fe2+,在Y中加入过量的氢氧化钠得固体Z为氢氧化铁和氢氧化亚铁,溶液W中含有偏铝酸根离子,Z在足量空气中生成固体M为氢氧化铁,氢氧化铁加热分解得铁红Fe2O3,
(1)根据上面的分析可知,气体X是氢气,化学式为H2,故答案为:H2;
(2)检验Fe3+的常用试剂是KSCN溶液,如果有Fe3+,则溶液出现血红色,故答案为:KSCN溶液;
(3)Fe、Al、Fe2O3、Al2O3中加入盐酸,可能发生Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+、Al+3Fe3+=3Fe2++Al3+,在溶液中氢气不能还原铁离子,所以溶液Y中Fe2+产生的原因不可能是H2+2Fe3+=2Fe2++2H+,故选d;
(4)溶液Y中有铝离子,加入氢氧化钠溶液生成氢氧化铝沉淀,氢氧化铝再与过量的氢氧化钠反应生成偏铝酸钠,反应的离子方程式为3OH-+Al3+=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,
故答案为:3OH-+Al3+=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O;
(5)步骤③是氢氧化亚铁在空气中被氧气氧化生成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(6)已知步骤①恰好完全反应消耗1mol/L盐酸1L,步骤④获得16.0gFe2O3,即0.1molFe2O3,根据元素守恒可知,Y中铁元素的物质的量为0.2mol,经检验溶液Y中不含Fe3+,Y中氯化亚的物质的量为0.2mol,根据氯元素守恒可知,Y中氯化铝中氯离子的物质的量为1mol-0.4mol=0.6mol,所以氯化铝的物质的量为0.2mol,根据铝元素守恒可知,则该废弃的合金中含有铝元素的质量为0.2mol×27g/mol=5.4g,
故答案为:5.4.
点评 本题考查物质的分离、提纯的方法及基本操作的综合应用,为高频考点,把握流程中物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析、推断及实验能力的综合考查,题目难度不大.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题
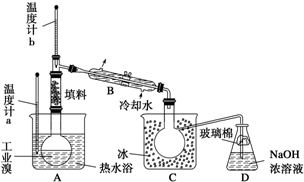 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图:
某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的任何物质,其物质的量必相等 | |
| B. | 相同条件下的一氧化碳气体和氮气,若体积相等,则质量也相等 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 在不同条件下,等物质的量的甲烷和一氧化碳所含的分子数一定不等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除③外 | B. | 除④外 | C. | 除③④外 | D. | 除②⑥外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:
50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2H2O2(l)=N2(g)+4H2O(l)△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)=N2(g)+4H2O(l)△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-817.63 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为AlCl3,则丁可能是NaOH | B. | 若甲为乙醇,则丙可能是乙酸 | ||
| C. | 若甲为Fe,则丁可能是稀硝酸 | D. | 若甲为NaOH 溶液,则丁可能是CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com