
【题目】(16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①反应的平衡常数表达式为K= 。由上表数据判断,该反应的△H 0(填“>”、“=”或“<”)。升高温度,正反应速率 (填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为 ,此时的温度为 。
(3)欲提高CO的转化率,可采取的措施是 。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
体系压强(Pa) | p1 | p2 | p3 | |
反应的能量变化 | akJ | bkJ | ckJ | |
原料转化率 | α1 | α2 | α3 | |
下列分析正确的是 。(填序号)
A.2c1<c3 B.2 p1<p3C.|a|+|b|=90.8 D.α1+α3>1
【答案】(1)BD(答对一个给1分)
(2)①![]() < 增大
< 增大
②80% 250℃
(3)DF(答对一个给1分)
(4)AC(答对一个给1分,见错不给分)
【解析】
试题(1)A、同一方向,错误;B、反应中气体的总物质的量变化,气体的质量不变,所以相对分子质量是变量,当不变时达到平衡,正确;C、密度是定值,错误;D、气体的压强与物质的量成正比,压强是变量,当不变时达到平衡,正确。(2)温度升高,K变小,反应放热;升高温度正逆反应速率均增大;通过平衡计算的三步法直接计算可得;(3)A、升温平衡逆向移动,转化率降低,错误;B、催化剂不改变平衡状态,错误;C、加入CO,其转化率降低,错误;D、加入氢气,增加CO转化率,正确;E、恒容条件下通入不反应的气体不能不移动,错误;F、降低生成物浓度,平衡正向移动,反应物转化率提高,正确;
(4)根据题意,把丙设置为丁,则甲乙丁为等效平衡,把丁压缩到一个容器中,增大压强,平衡向生成甲醇的方向移动,故有2c1<c3 ,压强2 p1>p3;甲乙是从两个不同方向进行到同一个平衡,故有
|a|+|b|=90.8 ,α1+α2 =1,丙中甲醇转化率小,故有α1+α3<1。


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述错误的是

A. 图甲表示分别用NaOH溶液滴定等浓度等体积的盐酸和醋酸溶液反应变化曲线,指示剂都可用酚酞
B. 图乙表示分别用等浓度AgNO3溶液滴定等浓度等体积的NaCl、NaBr及NaI溶液反应变化曲线(X-表示Cl-、Br-、I-),则c为I–(溶度积常数:Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl))
C. 图丙表示一定温度下,水溶液中H+和OH-的浓度变化曲线,b→a可能是加CuCl2溶液导致的
D. 图丁表示其他条件不变时,可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0 , C的物质的量分数与温度的关系
2C(g) ΔH<0 , C的物质的量分数与温度的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
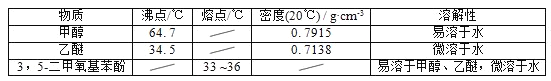
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
(1)科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,光能转化为________能,水分解时断裂的化学键是________(填“离子键”或“共价键”)
(2)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大量的热。若断开1mol氢气中的化学键消耗的能量为Q1kJ,断开1mol氧气中的化学键消耗的能量为Q2kJ,形成1mol水中的化学键释放的能量为Q3kJ,则下列关系正确的是____________
A.Q1+Q2<Q3 B.2Q1+Q2<2Q3
C.2Q1+Q2>2Q3 D.Q1+Q2>Q3
(3)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.C+H2O![]() CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O
(4)美国NASA曾开发一种铁·空气电池,其原理如图所示,电池反应为:2Fe+O2+2H2O=2Fe(OH)2。

①电极a为原电池的________(填“正极”或“负极”),该极的电极反应式为______________________;电极b上发生________反应(填“氧化”或“还原”)。
②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在2L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图。
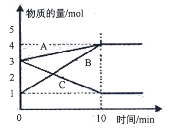
(1)该反应的化学方程式是________________________
(2)若A、B、C均为气体,10min后反应达到平衡,
①此时体系的压强是开始时的________倍。
②在该条件达到平衡时反应物的转化率为________%(计算结果保留1位小数)
(3)关于该反应的说法正确的是_________。
a.到达10min时停止反应
b.在到达10min之前C气体的消耗速率大于它的生成速率
c.在10min时B气体的正反应速率等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:_______。
②最外层电子数等于次外层电子数的元素原子:______。
(2)现有粒子:1H、35Cl、2H、14N、2H37Cl,其中:
①有_________种元素;
②__________之间互称同位素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应的能量变化如下图所示。下列有关叙述正确的是
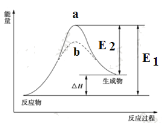
A. 该反应的焓变ΔH=E2-E1
B. a、b分别对应有催化剂和无催化剂的能量变化
C. 催化剂能改变反应的焓变
D. 催化剂能降低反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对图中的表述中正确的是( )
A.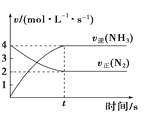 图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
B. 图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
C.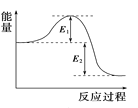 图可表示某化学反应属于放热反应,放出的能量为E1+E2
图可表示某化学反应属于放热反应,放出的能量为E1+E2
D.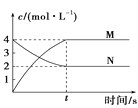 图涉及的反应可能为N(aq)2M(aq)
图涉及的反应可能为N(aq)2M(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com