
| A. | K3C60中既有离子键又有非极性键 | |
| B. | 1mol K3C60中含有的离子数目为3NA | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式不能写作KC20 |
分析 A.一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
B.1mol K3C60中含有3mol钾离子、1mol阴离子;
C.含有自由移动离子或电子的物质能导电;
D.化学式表示该物质的组成.
解答 解:A.K3C60是离子化合物,阴阳离子之间存在离子键,C原子之间存在非极性共价键,故A正确;
B.1mol K3C60中含有3mol钾离子、1mol阴离子,所以1mol K3C60中含有的离子数目为4NA个,故B错误;
C.该物质是离子化合物,为电解质,在熔融状态下能电离出阴阳离子而导电,故C正确;
D.化学式表示该物质的组成,其化学式为K3C60,不能写为KC20,故D正确;
故选B.
点评 本题以信息给予为载体考查了离子化合物,为高频考点,明确该物质的构成微粒结合物质导电的原因来分析看到,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | 2Q1+Q2<4Q3 | D. | 2Q1+Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19世纪中叶,门捷列夫的突出贡献是发现元素周期律 | |
| B. | 在金属和非金属元素交界处最容易找到半导体材料 | |
| C. | 在过渡元素中容易找到各种优良的催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 根据硼在元素周期表中的位置,推测硼的最高价含氧酸的化学式可能是HBO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50.0 | 120.0 | 232.0 | 290.0 | 312.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Rn的原子核内中子数与质子数的差值为50 | |
| B. | Rn位于元素周期表中第六周期0族 | |
| C. | Rn的最外层电子排布式为6s26p6,化学性质不活泼 | |
| D. | 新铺大理石地面的居室,不用打开门窗换气,因为氡对人体无危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把铁块换成铁粉 | |
| B. | 将容器的体积压缩至原体积的一半 | |
| C. | 若保持压强不变,充入氮气使容器的体积增大 | |
| D. | 若保持体积不变,充入氮气使容器内的压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加压 | B. | 加催化剂 | C. | 降温 | D. | 升温 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
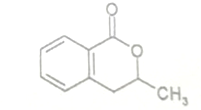
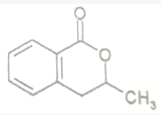 +H2O$\stackrel{NaOH}{→}$
+H2O$\stackrel{NaOH}{→}$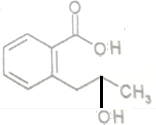 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com