
 CH3OH+H2O����ش��������⣺
CH3OH+H2O����ش��������⣺
|
|
|
|
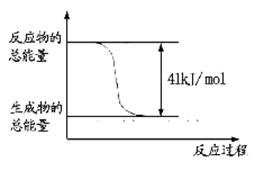
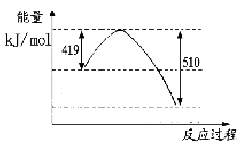 д���ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽ__ _��
д���ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽ__ _��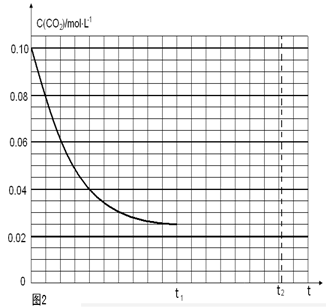
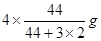 �����Ԧ�n(CO2)=" ��m��M="
�����Ԧ�n(CO2)=" ��m��M=" 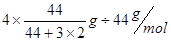 =0.08mol,���V(CO2)= ��c(CO2)�¦�t="(0.08mol" ��2L)��4min = 0.01mol/(L��min)��
=0.08mol,���V(CO2)= ��c(CO2)�¦�t="(0.08mol" ��2L)��4min = 0.01mol/(L��min)�� CH3OH(l)+H2O(l)����ʼʱc(CO2)=0.10mol/L��ƽ��ʱc(CO2)=0.025mol/L����c(CO2)=0.075mol/L������ƽ��ʱ�����ʵ�Ũ��Ϊ��c(H2)=0.075mol/L���÷�Ӧ��ƽ�ⳣ��
CH3OH(l)+H2O(l)����ʼʱc(CO2)=0.10mol/L��ƽ��ʱc(CO2)=0.025mol/L����c(CO2)=0.075mol/L������ƽ��ʱ�����ʵ�Ũ��Ϊ��c(H2)=0.075mol/L���÷�Ӧ��ƽ�ⳣ��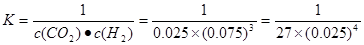 �������������������䣬t1ʱ���������ѹ����1L��c(CO2)=0.05mol/L��c(H2)=0.15mol/L��ƽ�������ƶ���������c(CO2)=xmol/L,������c(H2)=3xmol/L��ƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊc(CO2)="(0.05-x)mol/L" ��c(H2)="(0.15-3x)mol/L" ��ƽ�ⳣ�����䡣��
�������������������䣬t1ʱ���������ѹ����1L��c(CO2)=0.05mol/L��c(H2)=0.15mol/L��ƽ�������ƶ���������c(CO2)=xmol/L,������c(H2)=3xmol/L��ƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊc(CO2)="(0.05-x)mol/L" ��c(H2)="(0.15-3x)mol/L" ��ƽ�ⳣ�����䡣��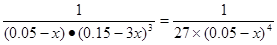 �����x= 0.025mol/L����t2�ﵽ�µ�ƽ��ʱc(CO2)=0.025mol/L.��t1��c(CO2)��ʱ��t�仯��������Ϊ��ͼ��ʾ��
�����x= 0.025mol/L����t2�ﵽ�µ�ƽ��ʱc(CO2)=0.025mol/L.��t1��c(CO2)��ʱ��t�仯��������Ϊ��ͼ��ʾ��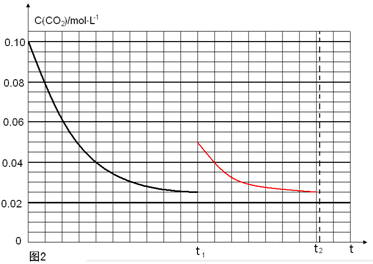 2Ũ����ʱ��ͼ��ı�ʾ��
2Ũ����ʱ��ͼ��ı�ʾ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2G(g)���й��������£�
2G(g)���й��������£�| | E��g�� | F��g�� | G��g�� |
| ��ʼŨ�ȣ�mol?L-1�� | 2.0 | 1.0 | 0 |
| ƽ��Ũ�ȣ�mol?L-1�� | c1 | c2 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CH3OCH3(g)��H2O(g)
CH3OCH3(g)��H2O(g)| ���� ��� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| �� | 387 | 0.40 | | |
| �� | 207 | 0.20 | 0.090 | 0.090 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A��ѹ�����������ѹǿ | B�������¶� | C����������ĵ��� | D��������SO2��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
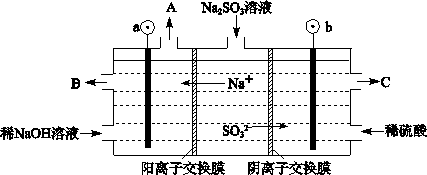
 �����ڼ��CO����Ӧԭ��Ϊ��
�����ڼ��CO����Ӧԭ��Ϊ��
 ����2L�ܱ������м�������
����2L�ܱ������м������� ����ͨ��1molCO��CO2���������
����ͨ��1molCO��CO2��������� ��ʱ��ı仯����ͼ��ʾ��
��ʱ��ı仯����ͼ��ʾ��
 _____________��
_____________�� ���������
��������� ���ɲ�ȡ�Ĵ�ʩΪ____________��
���ɲ�ȡ�Ĵ�ʩΪ____________�� Ϊ���������Խ�
Ϊ���������Խ� �Ļ������ֱ��ת��Ϊ���ᡣ
�Ļ������ֱ��ת��Ϊ���ᡣ ______________��
______________�� ________14(�>������<����=��)�����¶��´���ĵ��볣��K=__________(�ú�a��b��ʽ�ӱ�ʾ)��
________14(�>������<����=��)�����¶��´���ĵ��볣��K=__________(�ú�a��b��ʽ�ӱ�ʾ)�� ���Դ�������β���������÷�Ӧ���Ϊԭ��أ�������Na2O������ʣ��������缫��ӦʽΪ________________________________��
���Դ�������β���������÷�Ӧ���Ϊԭ��أ�������Na2O������ʣ��������缫��ӦʽΪ________________________________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g) ��H����196kJ/mol����߷�Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
2SO3(g) ��H����196kJ/mol����߷�Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��| A��SO2��O2��SO3���ߵ�Ũ��֮��Ϊ2��1��2 | B�������������ѹǿ���� |
| C�������ڻ��������ܶȱ��ֲ��� | D��SO3�����ʵ������ٱ仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
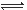 2Z(g)������˵����ȷ���� (����)
2Z(g)������˵����ȷ���� (����)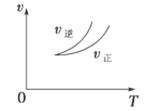
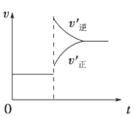
| A������ͼ˵������ӦΪ���ȷ�Ӧ |
| B����Ӧ��ƽ�������ѹǿ�����ܶȽ���С |
| C������ͼ�ɱ�ʾ�����¶�ʹƽ�����淴Ӧ�����ƶ� |
| D������ͼ���߿ɱ�ʾʹ�ô����������ķ�Ӧ���ʱ仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com