
尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
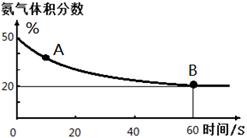 (1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s)
NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①关于上述反应的焓变、熵变说法正确的是 。
A.∆H<0 ,∆S<0 B.∆H>0, ∆S<0 C.∆H>0, ∆S>0 D.∆H<0, ∆S>0
②关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
 C.NH3的转化率始终等于CO2的转化率
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素。
此时溶液中c(NH4+)= ;
NH4+水解平衡常数值为 。
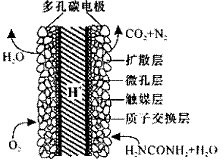
化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,写出该电池的负极反应式: 。
科目:高中化学 来源: 题型:
某反应A+B=C+D 在低温下能自发进行,在高温下不能自发进行,对该反应过程△H、△S的判断正确的是( )
|
| A. | △H<0△S>0 | B. | △H>0△S>0 | C. | △H<0△S<0 | D. | △H>0△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍.下列说法正确的是( )
|
| A. | R的原子半径比Z的大 |
|
| B. | R的氢化物的热稳定性比W的强 |
|
| C. | X与Y形成的化合物只有一种 |
|
| D. | Y的最高价氧化物的水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题:
(1)①反应Cl2+H2O⇌H++Clˉ+HClO其化学平衡常数K的表达式为:
②在25℃下,将a mol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合,反应平衡时溶液中c(NH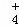 )=c(Cl﹣),试用含a的代数式表示NH3•H2O的电离常数Kb= .
)=c(Cl﹣),试用含a的代数式表示NH3•H2O的电离常数Kb= .
(2)常温下,向一定体积的0.1mol•L﹣1醋酸溶液中加水稀释后,下列说法正确的是 .
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中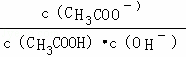 不变
不变
D.溶液中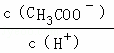 减小
减小
(3)①常温下将0.15mol•L﹣1的稀硫酸V1 mL与0.1mol•L﹣1的NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2= (溶液体积的变化忽略不计,硫酸电离方程式:H2SO4=2H++SO42﹣).
②常温下将pH=3的醋酸溶液V1 mL与pH=11的NaOH溶液V2 mL混合,则下列说法正确的是 .
A.若混合后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7 mol•L﹣1
B.若V1=V2,混合后溶液的pH一定等于 7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
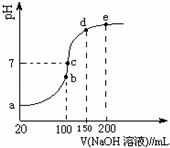
(4)NH4HSO4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a~e 5个点,回答下列问题:
①水的电离程度最大的是 点;
②在c点,溶液中各离子浓度由大到小的排列顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素互化物与卤素单质性质相似。已知CH2=CH—CH=CH2(1,3—丁二烯)与氯气发生加成产物有三种:
① CH2Cl—CHCl—CH=CH2 (1,2—加成)
② CH2Cl—CH=CH—CH2Cl (1,4—加成)
③ CH2Cl—CHCl—CHCl—CH2Cl(完全加成)
据此推测CH2=C(CH3)—CH=CH2(异戊二烯)与卤素互化物BrCl的加成产物有几种(不考虑顺反异构和镜像异构( )
A.6种 B.10种 C.12种 D.14种
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组用铝片与稀硫酸反应制取氢气,以下能够加快该反应速率的是( )
①用浓硫酸代替稀硫酸
②加热
③改用铝粉
④增大稀硫酸的体积
⑤加水
⑥加入少量硫酸铜
A.全部 B.②③⑥ C.①②③⑥ D.②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为2 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746.4 kJ·mol-1。起始反应时NO和CO各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) ΔH=-746.4 kJ·mol-1。起始反应时NO和CO各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A.反应前5秒钟内,用NO表示的平均反应速率为0.1 mol·L-1·s-1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2)
D.保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: 时,
时, 的
的 。下列判断正确的是
。下列判断正确的是
A.  时,饱和
时,饱和 溶液与饱和
溶液与饱和 溶液相比,前者的
溶液相比,前者的 大
大
B.  时,在
时,在 的悬浊液中加入少量的
的悬浊液中加入少量的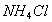 固体,
固体,  增大
增大
C.  时,
时, 固体在20mL0.01
固体在20mL0.01 氨水中的
氨水中的 比在20mL0,01
比在20mL0,01
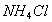 溶液中的
溶液中的 小,
小,
D.  时,在
时,在 的悬浊液中加入
的悬浊液中加入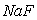 溶液后
溶液后 不可能转化为
不可能转化为
查看答案和解析>>
科目:高中化学 来源: 题型:
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
| 化学键 | H—H | Cl—Cl | Cl—H |
| 键能/(kJ·mol-1) | 436 | 243 | 431 |
请计算H2(g)+Cl2(g)===2HCl(g)的反应热( )
A.862 kJ·mol-1 B.679 kJ·mol-1
C.-183 kJ·mol-1 D.183 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com