
为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是
序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
① | KNO3溶液 | KOH | 滴入稀HNO3,同时用pH试纸测定至溶液呈中性 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 溶解、过滤、蒸发、结晶 |
A.①②③ B.②③④ C.①③④ D.①②③④
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:实验题
(14分)工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
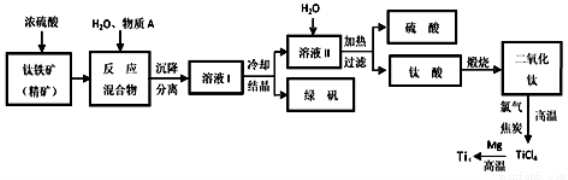
回答下列问题:
(1)钛铁矿和浓硫酸反应属于_________(选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g)
ΔH1 = -72 kJ?mol-1 TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g)
ΔH2 =+38.8kJ?mol-1
C(s)+CO2(g)=2CO(g)? ΔH3 =+282.8kJ?mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行
的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO
作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
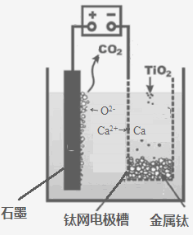
①写出阳极所发生反应的电极反应式:_______________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) _________。
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵阳市高三“一诊”模拟考试理综化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.Na2O2加入水制备O2:2O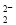 +2H2O=4OH-+O2↑
+2H2O=4OH-+O2↑
B.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO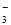 =Ag++NO↑+H2O
=Ag++NO↑+H2O
C.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO =BaSO4↓+2H2O
=BaSO4↓+2H2O
D. 向苯酚钠溶液中通入少量CO2:2C6H5O- + CO2 + H2O  2C6H5OH + CO
2C6H5OH + CO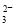
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.醋酸溶液中加入少量氢氧化镁固体:Mg(OH)2+2CH3COOH═Mg2++2CH3COO﹣+2H2O
B.H2O2溶液中加入足量酸性KMnO4溶液:2MnO4﹣+3H2O2+6H+═2Mn2++6H2O+4O2↑
C.Ca(HCO3)2溶液中加入足量澄清石灰水:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O
D.NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42﹣恰好沉淀完全:NH4++H++SO42﹣+Ba2++2OH﹣=NH3?H2O+BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三(补习班)10月月考理综化学试卷(解析版) 题型:实验题
(16分)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。

请回答下列问题:
(1)仪器中装入的试剂:B_________ 、D___________;
(2)连接好装置后应首先_________________________,(填写操作)
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是 _______________;在这两步之间还应进行的操作是____________________________
(4)写出反应过程中反应管E中的化学方程式:_______________ ,
(5)从实验中测得了下列数据
①空E管的质量a ; ②E管和WO3的总质量b ;③反应后E管和W粉的总质量c(冷却到室温称量);④反应前F管及内盛物的总质量d ;⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________;计算式2:Ar(W)=____________。
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:填空题
(12 分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
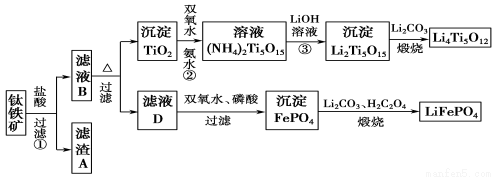
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)若在实验室中煅烧固体混合物,会用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有 (填仪器名称)。流程中多次涉及沉淀,则洗涤沉淀的方法是 。
(2)生产中利用滤渣A制备半导体的反应是 。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度有关,反应温度过高时,Ti元素浸出率会下降,其原因是 。
(5)写出由滤液D生成FePO4的离子方程式 。由滤液D制备LiFePO4的过程中,所需双氧水与H2C2O4的物质的量比是 。
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液:c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—)
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
下列说法正确的是
①乙烯的结构简式:CH2CH2
②HF的电子式: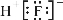
③HClO的结构式:H—O—Cl
④基态碳原子的价电子排布图: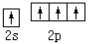
⑤基态Cr的价电子排布式:3d44s2
⑥斜长石KAlSi3O8的氧化物形式可表示为:K2O?Al2O3?6SiO2
A.①③ B.③④ C.④⑤ D.③⑥
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高三10月月考化学试卷(解析版) 题型:选择题
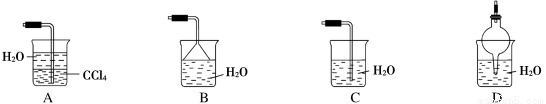
已知氨气极易溶于水,而难溶于有机溶剂CCl4,下列装置中不适宜做NH3的尾气吸收装置的是( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com